题目内容
10.有关电解质与非电解质的陈述,合理的是( )| A. | 在水溶液中能导电的化合物都是电解质 | |
| B. | 在熔融状态下不导电的化合物都是非电解质 | |
| C. | 氨水为混合物,不属于电解质 | |
| D. | 硫酸溶于水能导电,所以浓硫酸为电解质 |
分析 电解质:溶于水溶液中或在熔融状态下就能够导电,是自身电离,属于化合物;在水溶液中和在熔融状态下两种情况下都不能导电的化合物称为非电解质,据此解答即可.
解答 解:A、二氧化碳不能导电,但溶液水能导电,原因是由于二氧化碳溶于水生成碳酸导电,不是二氧化碳自身导电,故A错误;
B、HCl液态下不能电离出自由移动的离子,不能导电,但是溶于水可以导电,是电解质,故B错误;
C电解质属于化合物,氨水为氨气溶于水形成的混合物,不是电解质,故C正确;
D、浓硫酸为混合物,既不是电解质也不是非电解质,故D错误,
故选C.
点评 本题重点考查了电解质概念的辨析,解题时紧抓住电解质必须是化合物,导电是在水溶液或熔化状态下为条件,题目较简单.

练习册系列答案
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案
相关题目
20.密闭容器中可逆反应H2(g)+I2(g)?2HI(g)达到平衡的标志是( )
| A. | H2、I2、HI的浓度相等 | B. | H2、I2、HI的浓度保持不变 | ||
| C. | 混合气体的密度保持不变 | D. | 混合气体的压强不再改变 |
1.常用特定图案来表示危险化学品的类别.下列组合中图案与化学品性质相符的是( )
| A. |  H2 | B. |  浓盐酸 | C. |  浓硫酸 | D. |  CO2 |
18.元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用.
下表列出了①~⑩十种元素在周期表中的位置:
请回答下列问题:
(1)十种元素中化学性质最不活泼的是He(填元素符号 ).
(2)在②、③、④三种元素的氧化物对应的水化物中,碱性最强 的是NaOH(填化学式 ),其中含有化学键的类型有离子键、共价键.
(3)元素①、②、⑤原子半径由大到小的顺序为K>Na>H(填元素符号 ).
(4)元素⑦、⑧、⑨氢化物的稳定性由强到弱的顺序为HF>HCl>HBr(填化学式 ).
(5)十种元素中有一种元素的氢化物水溶液呈碱性,该氢化物的电子式为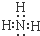 .
.
(6)十种元素中Al(填元素符号 )的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.
下表列出了①~⑩十种元素在周期表中的位置:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
(1)十种元素中化学性质最不活泼的是He(填元素符号 ).
(2)在②、③、④三种元素的氧化物对应的水化物中,碱性最强 的是NaOH(填化学式 ),其中含有化学键的类型有离子键、共价键.
(3)元素①、②、⑤原子半径由大到小的顺序为K>Na>H(填元素符号 ).
(4)元素⑦、⑧、⑨氢化物的稳定性由强到弱的顺序为HF>HCl>HBr(填化学式 ).
(5)十种元素中有一种元素的氢化物水溶液呈碱性,该氢化物的电子式为
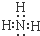 .
.(6)十种元素中Al(填元素符号 )的单质既可以和盐酸又可以和氢氧化钠溶液反应,其单质与氢氧化钠溶液反应的离子方程式为2Al+2OH-+2H2O═2AlO2-+3H2↑.
5.能正确表示下列反应的离子方程式是( )
| A. | 铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ | |
| B. | 过量氨水和氯化铝溶液反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 稀醋酸与氢氧化钠溶液的反应:H++OH-=H2O | |
| D. | 铜粉与稀HCl溶液的反应:Cu+2H+=Cu2++H2↑ |
15.有些商贩为了使银耳增白,就用硫磺(燃烧硫磺)对银耳进行熏制,用这种方法制取的洁白的银耳对人体是有害的.这些不法商贩制取银耳利用的是( )
| A. | S的漂白性 | B. | S的氧化性 | C. | SO2的漂白性 | D. | SO2的还原性 |
2.在下列反应中,硫元素表现出氧化性的是( )
| A. | 稀硫酸与锌反应 | B. | 二氧化硫与氧气反应 | ||
| C. | 浓硫酸与铜反应 | D. | 三氧化硫与水反应 |