题目内容
19.0.2 mol某元素R的单质与足量的盐酸反应,生成0.3 molH2;0.2 molR元素的单质与足量的氧气化合,生成10.2gR元素的最高价氧化物;R元素原子里中子数比质子数多1个.求R的相对原子质量及在元素周期表中的位置.(O相对原子质量为16)分析 元素R的单质与足量的盐酸反应生成H2,则R为金属元素,根据电子转移守恒计算反应中R的化合价,根据化合价可知氧化物的化学式,再根据氧化物的质量与物质的量计算R的相对原子质量,结合R元素原子里中子数比质子数多1个,计算R原子质子数,进而可以确定其再周期表中的位置.
解答 解:元素R的单质与足量的盐酸反应生成H2,则R为金属元素,
设R的化合价为a,根据电子转移守恒,则:0.2a=0.3×2,故a=3,即R的化合价为+3,
则其最高价氧化物的化学式为R2O3,其物质的量为$\frac{0.2mol}{2}$=0.1mol,M(R2O3)=$\frac{10.2g}{0.1mol}$=102g/mol,
所以Mr(R)=$\frac{102-16×3}{2}$=27,R为Al元素,位于周期表中第三周期ⅢA族,
答:R的相对原子质量为27,位于周期表第三周期ⅢA族.
点评 本题考查结构性质位置关系综合应用,关键是根据电子转移守恒计算的元素化合价并确定氧化物的化学式.

练习册系列答案
相关题目
9.由2-氯丙烷为主要原料制取1,2-丙二醇,经过的反应为( )
| A. | 加成-消去-取代 | B. | 消去-加成-取代 | C. | 取代-消去-加成 | D. | 取代-加成-消去 |
10.有关电解质与非电解质的陈述,合理的是( )
| A. | 在水溶液中能导电的化合物都是电解质 | |
| B. | 在熔融状态下不导电的化合物都是非电解质 | |
| C. | 氨水为混合物,不属于电解质 | |
| D. | 硫酸溶于水能导电,所以浓硫酸为电解质 |
7.F、Cl和Br都是 VIIA族元素,关于这三种元素原子的说法正确的是( )
| A. | 原子半径:F>Cl>Br | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数都相同 | D. | 最外层电子数依次增多 |
14.25℃时,下列有关溶液微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L CH3COONa与0.1 mol/L HCl溶液等体积混合:c(Na+)>c(Cl-)>cCH3COO-)>c(OH-) | |
| B. | 0.1mol/L NH4Cl与0.1mol/L 氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/L Na2CO3与0.1mol/L NaHCO3溶液等体积混合:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| D. | 0.11 mol/L CH3COOH溶液与 0.1 mol/L NaOH溶液等体积混合,所的溶液中:c(OH-)>c(H+)+c(CH3COOH) |
4.下列石油的分馏产物中,沸点最高的是( )
| A. | 汽油 | B. | 煤油 | C. | 柴油 | D. | 润滑油 |
11.向0.15mol Cu粉与Fe粉的混合物中加入一定量的稀硫酸产生气体XL,然后加入一定量的稀硝酸,充分反应后固体全部溶解,收集到NO气体Y L,(气体体积均已换算到标准状况).则X+Y的数值可能是( )
| A. | 1.12 | B. | 2.24 | C. | 2.8 | D. | 4.48 |
3.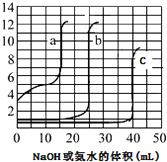 取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )
取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )
 取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )
取未知浓度的硫酸、盐酸和醋酸各25.00mL,分別用0.10mol•L-1的NaOH溶液或0.10mol•L-1 的稀氨水滴定得如图.下列说法正确的是( )| A. | 由图可知曲线c为NaOH滴定硫酸 | |
| B. | 由图可知硫酸的物质的量浓度大于盐酸的物质的量浓度 | |
| C. | 曲线b、c的滴定实验可用酚酞做指示剂 | |
| D. | 由图可知滴定前醋酸电离度约为1.67% |