题目内容
5.能正确表示下列反应的离子方程式是( )| A. | 铝片跟氢氧化钠溶液反应:Al+2OH-=AlO2-+H2↑ | |
| B. | 过量氨水和氯化铝溶液反应:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| C. | 稀醋酸与氢氧化钠溶液的反应:H++OH-=H2O | |
| D. | 铜粉与稀HCl溶液的反应:Cu+2H+=Cu2++H2↑ |
分析 A.漏写氧化剂水;
B.反应生成氢氧化铝和氯化铵;
C.醋酸在离子反应中保留化学式;
D.Cu与稀盐酸不反应.
解答 解:A.铝片跟氢氧化钠溶液反应的离子反应为2H2O+2Al+2OH-=2AlO2-+3H2↑,故A错误;
B.过量氨水和氯化铝溶液反应的离子反应为Al3++3NH3•H2O═Al(OH)3↓+3NH4+,故B正确;
C.稀醋酸与氢氧化钠溶液的反应CH3COOH+OH-=H2O+CH3COO-,故C错误;
D.Cu与稀盐酸不反应,不能写离子反应,故D错误;
故选B.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,选项D为解答的易错点,题目难度不大.

练习册系列答案
 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
15.有机物A为无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 | 解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为:90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为:C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)用结构简式表示A中含有的官能团: -COOH、-OH. |
(4)A的核磁共振氢谱如下图: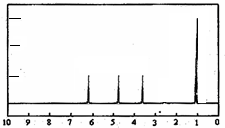 | (4)A中含有4种氢原子. |
(5)综上所述,A的结构简式  . . | |
16.在下列给定条件的溶液中,一定能大量共存的离子组是( )
| A. | 无色溶液:Ca2+、H+、Cl-、HSO3- | |
| B. | 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3- | |
| C. | Na2SO4溶液:K+、Fe3+、Cl-、NO3- | |
| D. | $\frac{kW}{c({H}^{+})}$=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3- |
13.下列叙述中能肯定说明金属A比金属B的活泼的是( )
| A. | A原子电子层数比B原子的电子层数多 | |
| B. | 常温时,A能从稀酸中置换出氢,而B不能 | |
| C. | A原子最外层电子数比B原子的最外层电子数少 | |
| D. | 1molA从酸中置换生成的H2比1mol B从酸中置换生成的H2多 |
20.某科研小组用MnO2和浓盐酸制备Cl2时,利用刚吸收过少量SO2的NaOH溶液对其尾气进行吸收处理.
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH=Na2SO3+H2O.
(2)反应Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O中的氧化剂为Cl2.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设.
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既不存在SO32-也不存在ClO-
②基于假设3(即验证假设3成立),设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3mol.L-1H2SO4、1mom.L-1NaOH、0.01mol.L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
(4)研究小组为测定某工厂区空气中SO2的含量,取10m3(标准状况)的空气,缓慢通过足量氯水中,在所得溶液中加入过量的BaC12溶液,将产生的白色沉淀洗涤、干燥,用电子称称其质量为0.233g.则此空气中SO2的浓度为6.4 mg/m3.(只要求计算结果,结果单位用mg/m3表示).
(1)请完成SO2与过量NaOH溶液反应的化学方程式:SO2+2NaOH=Na2SO3+H2O.
(2)反应Cl2+Na2SO3+2NaOH═2NaCl+Na2SO4+H2O中的氧化剂为Cl2.
(3)吸收尾气一段时间后,吸收液(强碱性)中肯定存在Cl-、OH-和SO42-.请设计实验,探究该吸收液中可能存在的其他阴离子(不考虑空气的CO2的影响).
①提出合理假设.
假设1:只存在SO32-;
假设2:只存在ClO-;
假设3:既不存在SO32-也不存在ClO-
②基于假设3(即验证假设3成立),设计实验方案,进行实验.请在答题卡上写出实验步骤以及预期现象和结论.限选实验试剂:3mol.L-1H2SO4、1mom.L-1NaOH、0.01mol.L-1KMnO4、淀粉-KI溶液、紫色石蕊试液.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol.L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | |
| 步骤2:向A试管中滴加1-2滴0.01mol.L-1KMnO4溶液. | 溶液呈浅紫色,则证明不存在SO32-, 则证明不存在SO32-. |
| 步骤3:向B试管中滴加1-2滴淀粉-KI溶液. | 溶液不变蓝色, 则证明不存在ClO-. |
10.有关电解质与非电解质的陈述,合理的是( )
| A. | 在水溶液中能导电的化合物都是电解质 | |
| B. | 在熔融状态下不导电的化合物都是非电解质 | |
| C. | 氨水为混合物,不属于电解质 | |
| D. | 硫酸溶于水能导电,所以浓硫酸为电解质 |
17.属于人工固氮作用的是( )
| A. | N2与H2在一定条件下反应生成NH3 | B. | 硝酸工厂用NH3氧化制NO | ||
| C. | 雷雨时空气中的N2转化为NO | D. | 由NH3制碳酸氢铵和硫酸铵 |
14.25℃时,下列有关溶液微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L CH3COONa与0.1 mol/L HCl溶液等体积混合:c(Na+)>c(Cl-)>cCH3COO-)>c(OH-) | |
| B. | 0.1mol/L NH4Cl与0.1mol/L 氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/L Na2CO3与0.1mol/L NaHCO3溶液等体积混合:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| D. | 0.11 mol/L CH3COOH溶液与 0.1 mol/L NaOH溶液等体积混合,所的溶液中:c(OH-)>c(H+)+c(CH3COOH) |
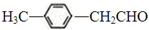 转化为对甲基苯乙炔
转化为对甲基苯乙炔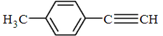 的合成路线流程图如下:
的合成路线流程图如下: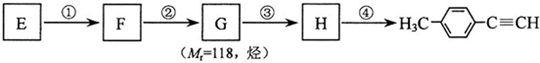
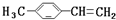 ,③的反应类型为加成反应.
,③的反应类型为加成反应. .
.