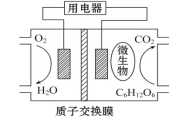
题目内容
【题目】利用下图装置测定中和热的实验步骤如下:

①量取50mL 0.25mol/L H2SO4溶液倒入小烧杯中,测量温度;
②量取50mL 0.55mol/L NaOH溶液,测量温度;
③将NaOH溶液倒入小烧杯中,混合均匀后测量混合液温度。请回答:
(1)如图所示,仪器A的名称是_______________;
(2)NaOH溶液稍过量的原因 ______________。
(3)加入NaOH溶液的正确操作是_______(填字母)。
A.沿玻璃棒缓慢加入 B.一次迅速加入 C.分三次加入
(4)使硫酸与NaOH溶液混合均匀的正确操作是 _________________________。
(5)实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是(填字母)______
a.实验装置保温、隔热效果差
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
c.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】环形玻璃搅拌棒 确保硫酸被完全中和 B 用环形玻璃搅拌棒轻轻上下搅动 abc
【解析】
根据简易量热计的构造及测量原理分析解答。
(1)如图所示,仪器A的名称是:环形玻璃搅拌棒,
故答案为:环形玻璃搅拌棒;
(2)NaOH溶液稍过量的原因是:确保硫酸被完全中和,
故答案为:确保硫酸被完全中和;
(3)为了保证热量不散失,加入NaOH溶液的正确操作是:一次迅速加入,
故答案为:B;
(4)使硫酸与NaOH溶液混合均匀的正确操作是用环形玻璃搅拌棒轻轻上下搅动,
故答案为:用环形玻璃搅拌棒轻轻上下搅动;
(5)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故b正确;
c.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故c正确,
故答案为:abc。

 快乐小博士巩固与提高系列答案
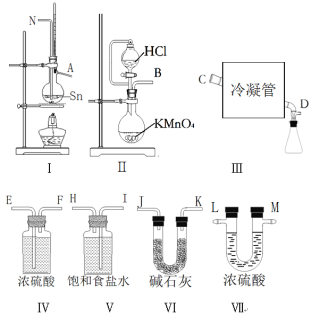
快乐小博士巩固与提高系列答案【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡与Cl2反应制备SnCl4。拟利用图中的仪器,设计组装一套实验装置制备SnCl4(每个装置最多使用一次)。
已知:①有关物理性质如下表
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ | |
Sn | 银白色固体 | 231.9 | 2260 | SnCl2易水解,SnCl4易水解生成固态二氧化锡, 锡与Cl2反应过程放出大量的热 |
SnCl4 | 无色液体 | -33 | 114 | |
SnCl2 | 无色晶体 | 246 | 652 |
②Fe3++Sn2+—Fe2++Sn4+ Fe2+ + Cr2O72- +H+—Fe3++Cr3++H2O(未配平)
回答下列问题:
(1)“冷凝管”的名称是________,装置Ⅱ中发生反应的离子方程式为________。
(2)用玻管(未画出)连接上述装置,正确的顺序是(填各接口的代码字母)_____。
(3)如何检验装置的气密性______,实验开始时的操作为_______。
(4)如果将制取的四氯化锡少许暴露于空气中,预期可看到的现象是出现白色烟雾,化学方程式为_______。
(5)可用重铬酸钾滴定法测定产品中的SnCl2的含量,准确称取该样品m g放于烧杯中,用少量浓盐酸溶解,加入过量的氯化铁溶液,再加水稀释,配制成250mL溶液,取25.00mL于锥形瓶中,用0.1000mol·L-1重铬酸钾标准溶液滴定至终点,消耗标准液15.00mL,则产品中SnCl2的含量为____%(用含m的代数式表示),在测定过程中,测定结果随时间延长逐渐变小的原因是____(用离子方程式表示)。