题目内容
【题目】浓度均为0.1mol/L的下列各组溶液,将溶液(Ⅱ)滴加到溶液(Ⅰ)中,测得溶液(I)的导电能力变化符合如图变化趋势的是( )
A | B | C | D | |
溶液(Ⅰ) | 盐酸 | 醋酸 | 氢氧化钠 | 氨水 |
溶液(Ⅱ) | 氢氧化钠 | 氢氧化钠 | 氨水 | 硝酸银 |
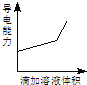
A.AB.BC.CD.D
【答案】BD
【解析】
A.浓度为0.1mol/L的盐酸,滴加同浓度的氢氧化钠溶液,生成氯化钠,溶液的体积变大,导致离子浓度减小,导电能力减弱,故A错误;
B.醋酸是弱电解质部分电离,向其中滴入氢氧化钠,生成的醋酸钠为强电解质,自由移动离子浓度增大,导电能力增强,故B正确;
C.氢氧化钠和氨水不反应,氨水是弱电解质,向氢氧化钠溶液中滴入氨水,相当于对氢氧化钠稀释,离子浓度减小,导电能力减弱,故C错误;
D.向氨水中滴入硝酸银,形成银铵络离子,先产生白色沉淀AgNO3+NH3H2O=AgOH+NH4NO3,继续滴加氨水,沉淀消失,发生AgOH+2NH3H2O=[Ag(NH3)2]OH +2H2O,而[Ag(NH3)2]OH是一元强碱,导致离子浓度增大,导电能力增强,故D正确;
选BD。

练习册系列答案
相关题目
【题目】室温时几种物质的溶解度见下表。室温下,向500g硝酸钾饱和溶液中投入2g食盐,下列推断正确的是( )
物质 | 溶解度( g/100g水) |
氯化钠 | 36 |
硝酸钾 | 32 |
硝酸钠 | 87 |
氯化钾 | 37 |
A.食盐不溶解
B.食盐溶解,无晶体析出
C.食盐溶解,析出2 g硝酸钾晶体
D.食盐溶解,析出2 g氯化钾晶体