题目内容
6.次磷酸(H3PO2)是一种一元中强酸,具有较强的还原性.试回答下列问题:(1)P的原子结构示意图为
 ;
;(2)NaH2PO2为正盐(填“正盐”或“酸式盐”),溶液中有关离子浓度从大到小的顺序为c(Na+)>c(H2PO2-)>c(OH-)>c(H+).
(3)H3PO2可将溶液中的银离子还原为银单质,若该反应的氧化产物的化学式为H3PO4,则氧化剂与还原剂的物质的量之比为4:1.
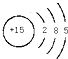
分析 (1)磷是15号元素,原子核外有3个电子层,由里到外各层电子数为2、8、5;
(2)H3PO2是一元中强酸,则NaH2PO2为正盐,酸根离子在水溶液里水解导致溶液呈碱性;
(3)银离子还原为银单质,反应中银离子是氧化剂,氧化产物的化学式为H3PO4,则H3PO2是还原剂,根据转移电子守恒计算氧化剂与还原剂的物质的量之比.
解答 解:(1)磷是15号元素,原子核外有3个电子层,由里到外各层电子数为2、8、5,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)H3PO2是一元中强酸,则NaH2PO2为正盐,酸根离子在水溶液里水解导致溶液呈碱性,溶液中离子浓度大小为:c(Na+)>c(H2PO2-)>c(OH-)>c(H+),
故答案为:正盐; c(Na+)>c(H2PO2-)>c(OH-)>c(H+);
(3)银离子还原为银单质,反应中银离子是氧化剂,氧化产物的化学式为H3PO4,则H3PO2是还原剂,根据转移电子守恒,n(Ag+)=n(H3PO2)×(5-1),即n(Ag+):n(H3PO2)=4:1,
故答案为:4:1.
点评 本题考查氧化还原反应、盐类水解、核外电子排布等,题目难度不大,侧重对基础知识的巩固.

练习册系列答案
相关题目
16.在周期表中,下列各组元素位于同主族的是( )
| A. | Mg、Al | B. | Se,Br | C. | Si、Ge | D. | S、As |
17.如表是A、B、C、D、E五种有机物的有关信息;
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式 .
.
(2)A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: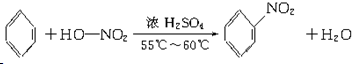 .
.
(4)C与E反应能生成相对分子质量为100的酯,其化学反应方程式为:CH2=CHCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH2=CHCOOOCH2CH3+H2O.
(5)写出由D还原生成C的化学反应方程式:CH3CHO+H2 $\stackrel{催化剂}{→}$CH3CH2OH.
| A | B | C | D | E |
| ①能使溴的四氯化碳溶液褪色; ②比例模型为:  ③能与水在一定条件下反应生成C | ①由C、H两种元素组成; ②球棍模型为: 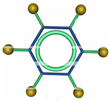 | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯. | ①相对分子质量比C少2; ②能由C氧化而成; | ①由C、H、O三种元素组成; ②球棍模型为: 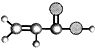 |
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做1,2-二溴乙烷;写出在一定条件下,A生成高分子化合物的化学反应方程式
 .
.(2)A与氢气发生加成反应后生成分子F,F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2.当n=4时,这类有机物开始出现同分异构体.
(3)B具有的性质是②③(填号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与酸性KMnO4溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:
 .
.(4)C与E反应能生成相对分子质量为100的酯,其化学反应方程式为:CH2=CHCOOH+CH3CH2OH$→_{△}^{浓硫酸}$CH2=CHCOOOCH2CH3+H2O.
(5)写出由D还原生成C的化学反应方程式:CH3CHO+H2 $\stackrel{催化剂}{→}$CH3CH2OH.
14.几种短周期元素的原子半径及主要化合价如表:
下列叙述不正确的是( )
| 元素代号 | X | Y | Z | W | V |
| 原子半径/nm | 0.090 | 0.118 | 0.075 | 0.073 | 0.102 |
| 主要化合价 | +2 | +3 | +5、+3、-3 | -2 | +6、-2 |
| A. | X、Z、W位于同周期,Y与V位于同周期 | |
| B. | Y3+与V2-的核外电子数相等 | |
| C. | Y与W形成的化合物具有两性 | |
| D. | Z的氢化物可与V的最高价氧化物的水溶液反应生成盐 |
1.含有Ag+、Al3+、Mg2+、Ba2+等四种金属离子的混合溶液.欲使上述四种离子分别以沉淀形式从溶液中分离出来.下列加入试剂的顺序能达到实验目的是( )
| A. | NaOH、NaCl、HCl、Na2SO4 | B. | NaCl、Na2SO4、NaOH、HCl | ||
| C. | NaCl、NaOH、Na2SO4、HCl | D. | Na2SO4、NaOH、NaCl、HCl |
18.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | pH相同的①CH3COONa、②NaHCO3、③NaClO三种溶液的c(Na+):①>②>③ | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
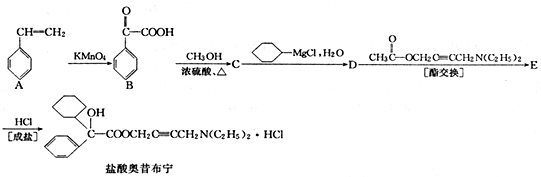
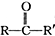 +
+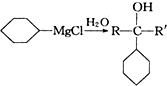 请回答下列问题
请回答下列问题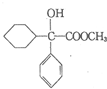 .
.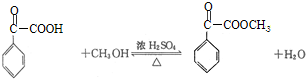 ,属取代反应.
,属取代反应.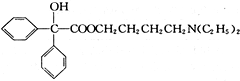 互为同分异构体
互为同分异构体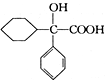 可发生缩聚反应.
可发生缩聚反应.