题目内容
【题目】(1)①写出二氧化碳的电子式:________________;
②写出赤铁矿石主要成份的化学式:___________________。
③写出氨分子的结构式:__________________。
(2)写出镁在二氧化碳中燃烧的化学方程式__________________________________________________。
(3)写出铜与氯化铁溶液反应的离子方程式:________________________________________________。
【答案】![]() Fe2O3
Fe2O3 ![]() 2Mg + CO2
2Mg + CO2 ![]() 2MgO + C Cu + 2Fe3+ = Cu2+ + 2Fe2+
2MgO + C Cu + 2Fe3+ = Cu2+ + 2Fe2+
【解析】
(1)电子式根据原子之间形成的共用电子对分析;
(2)赤铁矿为氧化铁。
(3)氨气分子含有三个氮氢键,据此书写结构式;
(4)根据镁和二氧化碳反应生成氧化镁和碳书写方程式;
(5)根据铜和氯化铁反应生成氯化铜和氯化亚铁书写离子方程式。
(1).二氧化碳的电子式为 ![]() ;
;
(2)赤铁矿为氧化铁,化学式为 Fe2O3 ;
(3)氨气分子中含有三个氮氢键,故结构式为 ![]() ;
;
(4)镁和二氧化碳反应生成氧化镁和碳,方程式为:2Mg + CO2 ![]() 2MgO + C;
2MgO + C;
(5)铜和氯化铁反应生成氯化亚铁和氯化铜,离子方程式为: Cu + 2Fe3+ = Cu2+ + 2Fe2+。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
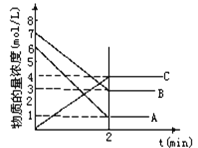
名题训练系列答案【题目】I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得:(8分钟时A为0.2mol 、B为0.5mol)
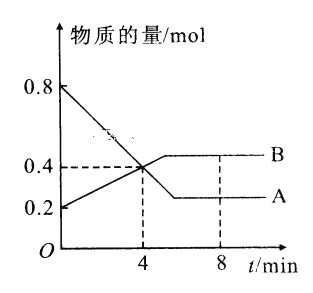
(1)该反应的化学方程式为_________________________。
(2)反应开始时至4min时,A的平均反应速率为________。
(3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>”“<”或“=”)。
II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是________。
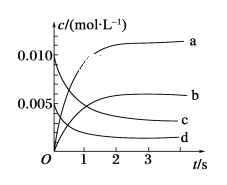
(3)能说明该反应已达到平衡状态的是________(填序号)。
a. v(NO2)=2v(O2) b.容器内压强保持不变
c. v逆(NO)=2v正(O2) d. 容器内密度保持不变
【题目】E和F加入密闭容器中,在一定条件下发生反应:E(s)+4F(g)![]() G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
G(g),已知该反应的平衡常数值如下表所示。下列说法正确的是
温度℃ | 25 | 80 | 230 |
平衡常数值 | 5×104 | 2 | 1.9× 10﹣5 |
A.上述反应是熵增反应
B.25℃时,反应G(g)![]() E(s)+4F(g)的平衡常数值是0.5
E(s)+4F(g)的平衡常数值是0.5
C.在80℃时,测得某时刻,F、G浓度均为0.5 mol·L﹣1,则此时v(正)>v(逆)
D.恒温恒容下,向容器中再充入少量G(g),达新平衡时,G的体积百分含量将增大