题目内容
【题目】某厂排出的废液主要含有硝酸锌和硝酸银,为了从中回收金属银和硝酸锌,某中学化学课外活动小组设计了以下的实验步骤:
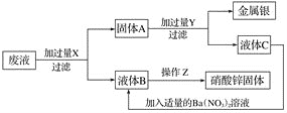
(1)X是____________,Y是____________ (写化学式,下同)。
(2)固体A、滤液B、C的主要成分:A______________,B______________,C______________。
(3)Z处进行的操作是__________________________。
【答案】Zn H2SO4 Zn和Ag Zn(NO3)2 ZnSO4 先过滤,再将滤液蒸发结晶
【解析】
实验的目的是回收金属银和硝酸锌,因此第一步应向混合溶液中加入足量的锌来置换出银,由于锌过量,因此固体A是锌和银的混合物,利用金属活动性的差异可以溶解锌而得到纯净的银,结合滤液C中加入适量的硝酸钡溶液可得液体B,可知Y应为稀硫酸。
(1)我们向废液中加入过量的锌,让锌与硝酸银反应 Zn+2AgNO3=2Ag+Zn(NO3)2然后过滤,得到固体A(Zn和 Ag)和液体B Zn(NO3)2溶液,为了把固体A中的银和锌分开,我们可以加入过量的Y即稀硫酸溶液,故X、Y的化学式:X:Zn,Y:H2SO4;
(2)固体A中加入过量Y即稀硫酸溶液后,其中锌与稀硫酸反应会生成硫酸锌,故滤液C为硫酸锌溶液,故固体A和滤液B、C中主要成分的化学式:A:Ag,Zn;B:Zn(NO3)2;C:ZnSO4;
(3)液体B为Zn(NO3)2溶液,要想得到硝酸锌固体,我们可以对溶液进行加热蒸发,故Z处进行的操作是先过滤,再将滤液蒸发结晶;
故答案为:
(1)X:Zn;Y:H2SO4
(2)A:Ag,Zn;B:Zn(NO3)2;C:ZnSO4;
(3)先过滤,再将滤液蒸发结晶。

【题目】POCl3是重要的基础化工原料,广泛用于制药、染料、表面活性剂等行业。一种制备POCl3的原理为:PCl3+Cl2+SO2=POCl3+SOCl2。某化学学习小组拟利用如下装置在实验室模拟制备POCl3。有关物质的部分性质如下:
物质 | 熔点/℃ | 沸点/℃ | 密度/g·mL-1 | 其它 |
PCl3 | -93.6 | 76.1 | 1.574 | 遇水强烈水解,易与氧气反应 |
POCl3 | 1.25 | 105.8 | 1.645 | 遇水强烈水解,能溶于PCl3 |
SOCl2 | -105 | 78.8 | 1.638 | 遇水强烈水解,加热易分解 |
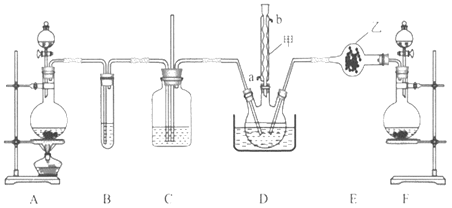
(1)仪器甲的名称为______________,与自来水进水管连接的接口编号是________________。(填“a”或“b”)。
(2)装置C的作用是___________________,乙中试剂的名称为____________________。
(3)该装置有一处缺陷,解决的方法是在现有装置中再添加一个装置,该装置中应装入的试剂为_________(写名称)。若无该装置,则可能会有什么后果?请用化学方程式进行说明__________________________。
(4)D中反应温度控制在60-65℃,其原因是_______________。
(5)测定POCl3含量。①准确称取30.70gPOCl3产品,置于盛有60.00mL蒸馏水的水解瓶中摇动至完全水解;②将水解液配成100.00mL溶液,取10.00mL溶液于锥形瓶中;③加入10.00mL3.200mol/LAgNO3标准溶液,并加入少许硝基苯用力摇动,使沉淀表面被有机物覆盖;④以Fe3+为指示剂,用0.2000mol/LKSCN溶液滴定过量的AgNO3溶液,达到滴定终点时共用去10.00mLKSCN溶液。
①滴定终点的现象为____________________,用硝基苯覆盖沉淀的目的是__________________。
②反应中POCl3的百分含量为__________________。
【题目】羰基硫(COS)常用作粮食熏蒸剂,制取反应为 CO(g)+H2S(g) ![]() COS(g)+H2(g),△H=-30kJ·mol-1。在恒容的密闭容器中不同条件下发生反应并达到平衡,数据如下表。
COS(g)+H2(g),△H=-30kJ·mol-1。在恒容的密闭容器中不同条件下发生反应并达到平衡,数据如下表。
实验 | 温度/℃ | n起始/mol | 平衡时 | 所需时间 | |||
CO | H2S | COS | H2 | n(CO)/mol | min | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 | e |
2 | 150 | 7.0 | 7.0 | 3.0 | 3.0 | a | f |
3 | 200 | 20.0 | 20.0 | 0 | 0 | 16.0 | g |
下列说法错误的是
A. 实验1 反应开始到平衡整个过程中放出的热量为 90kJ
B. 实验2 达平衡时,a>7.0
C. 实验3 时间:g<e
D. 实验3 CO 达到平衡时的转化率比实验1 小