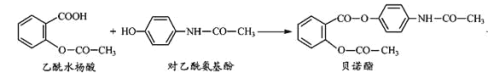
��Ŀ����
����Ŀ��(1)25��ʱ��Ũ�Ⱦ�Ϊ 0.10molL��1 �İ�ˮ�� NH4 Cl ��Һ
��NH4 Cl ��Һ��________�ԣ�ԭ����(�����ӷ���ʽ��ʾ)________�������������İ�ˮ��ʹ��Һ�� c(NH4+)=c(Cl��)������Һ�� pH________7 (��������������������=��).
�ڰ�ˮ�Լ��Ե�ԭ��(�����ӷ���ʽ��ʾ)________����ˮ�м��� NH4Cl ���壬��ˮ�ĵ���̶�________(����������������С������������)����Һ�� pH ��________(����������������С������������)��
(2)������ʵ�У���˵�� NH3��H2O�������________
��0.1 mol��L��1 NH3��H2O ��Һ����ʹ��̪��Һ���
��0.1 mol��L��1 NH4Cl ��Һ������
��0.1 mol��L��1NH3��H2O ��Һ�ĵ��������� 0.1 mol��L��1NaOH ��Һ��
�ܵ������ 0.1 mol��L��1NH3��H O ��Һ�� 0.1 mol��L��1 HCl ��Һǡ����ȫ��Ӧ
A.�٢ڢ� B.�ڢ� C.�ڢ� D.�ۢ�
���𰸡��� NH4++H2O![]() NH3��H2O+H+ 7 NH3��H2O
NH3��H2O+H+ 7 NH3��H2O![]() NH4++ OH- ��С ��С B
NH4++ OH- ��С ��С B
��������
��1����NH4ClΪǿ�������Σ�笠�����ˮ�⣺NH4++H2O![]() NH3��H2O+H+������Һ�����ԣ����������İ�ˮ��ʹ��Һ�� c(NH4+)=c(Cl��)��������Һ�д��ڵ���غ㣺c(NH4+)+c(H+)=c(Cl��)+c(OH-)������Һ�����ԣ�pH=7���ʴ�Ϊ���NH4++H2O
NH3��H2O+H+������Һ�����ԣ����������İ�ˮ��ʹ��Һ�� c(NH4+)=c(Cl��)��������Һ�д��ڵ���غ㣺c(NH4+)+c(H+)=c(Cl��)+c(OH-)������Һ�����ԣ�pH=7���ʴ�Ϊ���NH4++H2O![]() NH3��H2O+H+��7��
NH3��H2O+H+��7��
�ڰ�ˮΪ������ڵ���ƽ�⣬NH3��H2O![]() NH4++ OH-����ˮ�м��� NH4Cl ���壬NH4+���࣬��ˮ�ĵ���ƽ�������ƶ�������̶ȼ�С��c(OH-)��С����Һ�� pH����С���ʴ�Ϊ��NH3��H2O
NH4++ OH-����ˮ�м��� NH4Cl ���壬NH4+���࣬��ˮ�ĵ���ƽ�������ƶ�������̶ȼ�С��c(OH-)��С����Һ�� pH����С���ʴ�Ϊ��NH3��H2O![]() NH4++ OH-����С����С��
NH4++ OH-����������
��2���ټ�������Һ������ʹ��̪��Һ��죬����˵�� NH3��H2O���������
��NH4ClΪǿ�������Σ�笠�����ˮ�⣺NH4++H2O![]() NH3��H2O+H+������Һ�����ԣ���˵�� NH3��H2O�������ȷ
NH3��H2O+H+������Һ�����ԣ���˵�� NH3��H2O�������ȷ
��Ũ����ȣ���Һ�ĵ�������������Ũ�ȳ����ȣ�NH3��H2O ��Һ�ĵ���������NaOH��Һ����˵����ˮ���ֵ��룬Ϊ�������ȷ��
�������ȡ�Ũ����ȣ����ʵ�����ȣ�������ǿ������������ǡ����ȫ��Ӧ������˵�� NH3��H2O����ܴ��� ѡB���ʴ�Ϊ��B��

 53������ϵ�д�
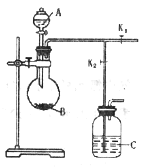
53������ϵ�д�����Ŀ����ͼ�����÷�ͭм�������������Ʊ�����������ͭ���壩�����̡�
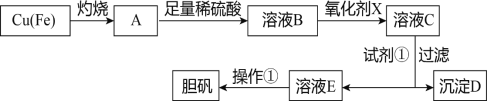
����������������������ʽ����ʱ��Һ��pH���±���
������ | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
��ʼ���� | 2.7 | 7.5 | 4.4 |
��ȫ���� | 3.7 | 9.7 | 6.7 |
��ش�
��1����ҺB�к��е���������____________________�������ӷ��ţ���
��2��������������������������X����__________������ĸ����
a��NaClO b��H2O2 c��KMnO4
��3�������Լ�����Ϊ�˵���pH��Ҫ����pH��Χ��_____________�����Լ��ٿ���ѡ��______________���ѧʽ����
��4������D������������ۣ������Ƶ�FeCl2��Һ��ʵ���ұ���FeCl2��Һ���������������ۣ���ԭ����____________________________________�������ӷ���ʽ��ʾ����
��5����ҺE���������ٿɵõ�������������Ϊ________________________�����ˡ�ϴ�ӡ�
��6����֪��Һ��c��Cu2+����pH�Ĺ�ϵΪlgc��Cu2+��=8.6-2pH������Һ��c��Cu2+��Ϊ1mol/L����ʱ��Һ�е�Fe3+�ܷ������ȫ��___________����ܡ��� ��