题目内容
【题目】汽车尾气里含有 NO 气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)2NO(g) ΔH>0,已知该反应在 240℃时,平衡常数 K=64×10-4。请回答:
(1)该温度下,向 2 L 的密闭容器中充入 N2 和 O2 各 1 mol,5分钟后O2的物质的量为 0.5 mol,则 用N2表示的反应速率为________。
(2)假定该反应是在恒容条件下进行,判断该反应达到平衡的标志________ (填字母序号)。
A.消耗 1 mol N2 同时生成 1 mol O2 B.混合气体密度不变
C.混合气体平均相对分子质量不变 D.2v(N2)正=v(NO)逆
(3)将 N2、O2 的混合气体充入恒温恒容密闭容器中,下列变化趋势正确的是________ (填字母序号)。
A. 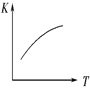 B.
B.  C.
C. 
(4)该温度下,某时刻测得容器内 N2 、O2、NO 的浓度分别为 2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和 3.0×10-3mol·L-1,此时反应________ (填“处于化学平衡状态”“向正反应方向进行”或“向逆反应方向进行”),理由是________
【答案】![]() AD AC 向正反应方向进行 因为浓度商Qc<K
AD AC 向正反应方向进行 因为浓度商Qc<K
【解析】
(1)5min之内,氧气的物质的量浓度的变化量为![]() ,则
,则![]() ;
;
故答案为:![]() ;
;
(2)A. 消耗1molN2等效于消耗1molO2,同时生成1molO2,说明正逆反应速率相等,反应达到平衡,A正确;
B. 总体积不变,总质量不变,混合气体密度一直不变,不能作为反应达到平衡的标志,B错误;
C. 总质量不变,总物质的量不变,混合气体的平均相对分子质量一直不变,不能作为反应达到平衡的标志,C错误;
D.2v正(N2)=v正(NO) =v逆(NO),说明正逆反应速率相等,反应达到平衡,D正确;
故答案为:AD;
(3)A. 该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大,A正确;
B. 加入催化剂,反应速率增大,但平衡不发生移动,B错误;
C. 升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大,C正确;
故答案为:AC;
(4)该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10-1 mol·L-1、4.0×10-2 mol·L-1和 3.0×10-3mol·L-1,则该时刻生成物的浓度幂之积与反应物浓度幂之积的比值为: =9×104<K,则反应应向正反应方向进行;
=9×104<K,则反应应向正反应方向进行;
故答案为:向正反应方向进行;因为浓度商Qc<K;