题目内容
11.有aXn+和bYm-两种元素的简单离子,若它们的电子层结构相同,则下列关系正确的是( )| A. | X与Y处于同一周期 | B. | 原子序数:a<b | ||
| C. | a-b=m+n | D. | 离子半径:Xn+>Ym- |
分析 由aXn+和bYm-的电子层结构相同知,这两种离子的核外电子数相等,核外电子数=核内质子数-阳离子的电荷数=核内质子数+阴离子的电荷数,所以得:a-n=b+m,即a-b=n+m,可知a在b的下一周期,具有相同电子层结构的离子,核电荷数越大离子半径越小,以此解答该题.
解答 解:由aXn+和bYm-的电子层结构相同知,这两种离子的核外电子数相等,核外电子数=核内质子数-阳离子的电荷数=核内质子数+阴离子的电荷数,所以得:a-n=b+m,即a-b=n+m,
A.a-b=n+m,可知a在b的下一周期,故A错误;
B.a-b=n+m,则原子序数:a>b,故B错误;
C.由分析可知a-b=n+m,故C正确;
D.电子层结构相同的离子,离子半径随着原子序数增大而减小,原子序数X>Y,所以离子半径Ym->Xn+,故D错误;
故选C.
点评 本题考查电子层结构相同离子的比较,侧重考查学生分析判断能力,涉及离子半径比较、元素位置比较,知道阴阳离子核外电子数的计算方法,题目难度不大.

练习册系列答案
相关题目
16.关于如图不正确的说法是( )
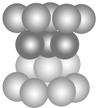

| A. | 此种堆积为面心立方最密堆积 | |
| B. | 该种堆积方式称为铜型 | |
| C. | 该种堆积方式可用符号…ABCABC…表示 | |
| D. | 该种堆积方式所形成晶胞中原子的空间占有率为68% |
6.已知β锂辉矿(主要成分为LiAlSi2O6,还含有FeO、MgO、CaO等杂质),下面是以锂辉矿为原料来制取金属锂的一种工艺流程.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
②Li2CO3在不同温度下的溶解度如下表:
请回答下列问题:
(1)为了提高β锂辉矿浸出率可采取措施有适当提高溶液的温度或粉碎锂辉矿增大接触面积或多次浸出或延长浸出时间或多次搅拌.
(2)反应Ⅰ发生主反应:2LiAlSi2O6+4 H2SO4(浓)1Li2SO4+Al2(SO4)3+4SiO2+4 H2O,根据题意配平上述方程式.
(3)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(4)反应Ⅲ中生成沉淀A成分:Mg(OH)2、CaCO3.(填化学式)
(5)蒸发浓缩过程中主要发生离子反应方程式:2Li++CO32-=Li2CO3↓.
(6)洗涤所得Li2CO3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(7)电解熔融氯化锂生产锂时,阳极产生的Cl2中会混有少量O2,用电极反应式说明原因加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2,2O2--4e-=O2↑.

已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)为了提高β锂辉矿浸出率可采取措施有适当提高溶液的温度或粉碎锂辉矿增大接触面积或多次浸出或延长浸出时间或多次搅拌.
(2)反应Ⅰ发生主反应:2LiAlSi2O6+4 H2SO4(浓)1Li2SO4+Al2(SO4)3+4SiO2+4 H2O,根据题意配平上述方程式.
(3)反应Ⅱ加入碳酸钙的作用是除去反应Ⅰ中过量的H2SO4;控制pH,使Fe3+、Al3+完全沉淀.
(4)反应Ⅲ中生成沉淀A成分:Mg(OH)2、CaCO3.(填化学式)
(5)蒸发浓缩过程中主要发生离子反应方程式:2Li++CO32-=Li2CO3↓.
(6)洗涤所得Li2CO3沉淀要使用热水(选填“热水”或“冷水”),你选择的理由是Li2CO3在较高温度下溶解度小,用热水洗涤可减少Li2CO3的损耗.
(7)电解熔融氯化锂生产锂时,阳极产生的Cl2中会混有少量O2,用电极反应式说明原因加热蒸干LiCl溶液时,LiCl有少量水解生成LiOH,受热分解生成Li2O,电解时产生O2,2O2--4e-=O2↑.
16.如表给出几种氯化物的熔、沸点:
则下列各项表述与表中数据一致的有( )
①CaCl2属于离子晶体 ②SiCl4是分子晶体
③1500℃时,NaCl可气化 ④MgCl2水溶液不能导电.
| NaCl | MgCl2 | CaCl2 | SiCl4 | |
| 熔点(℃) | 801 | 712 | 782 | -68 |
| 沸点(℃) | 1 465 | 1 412 | 1 600 | 57.6 |
①CaCl2属于离子晶体 ②SiCl4是分子晶体
③1500℃时,NaCl可气化 ④MgCl2水溶液不能导电.
| A. | 仅① | B. | 仅② | C. | ①②④ | D. | ①②③ |
20.下列反应是氧化还原且不是四种基本反应类型的是( )
| A. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | B. | NaOH+HCl═NaCl+H2O | ||
| C. | Fe+CuSO4═Cu+FeSO4 | D. | Fe2O3+3CO $\frac{\underline{\;高温\;}}{\;}$ 2Fe+3CO2 |
1.下列物质属于非电解质的是( )
| A. | H2SO4 | B. | Cl2 | C. | CaCO3 | D. | CO2 |