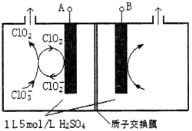
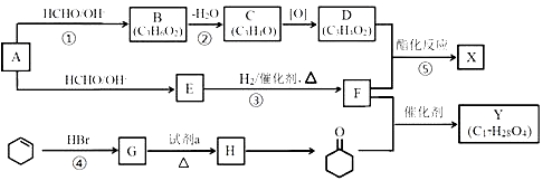
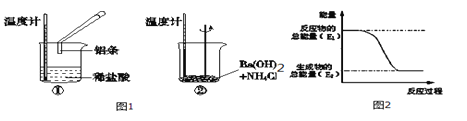
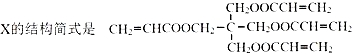题目内容
【题目】常温下,向1L0.1molL-1CH3COONa溶液中,不断通入HCl气体。CH3COO-与CH3COOH 的变化趋势如图所示(假设HCl完全吸收且不考虑CH3COOH挥发及溶液体积变化),下列说法不正确的是
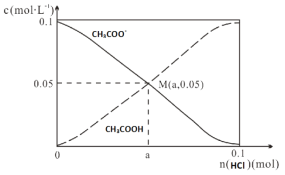
A.M点溶液中水的电离程度比原溶液小
B.在M点时,n(H+)-n(OH-)=(0.05-a )mol
C.随着HCl的加入,![]() 不断减小
不断减小
D.当n(HCl)=0.1mol时,c(Cl-)>c(CH3COOH)>c(H+)
【答案】B
【解析】
试题分析:A、向醋酸钠溶液中不断通入氯化氢气体,对水的电离起抑制作用,所以M点溶液中水的电离程度比原溶液小,A正确;n(HCl)=amol,n(CH3COO-)=0.05mol,n(Na+)=0.1 mol,根据电荷守恒可得n(CH3COO-)+n(OH-)+n(Cl-)=n(H+)+n(Na+),n(H+)-n(OH-)=n(CH3COO-)+n(Cl-)-n(Na+)=(a -0.05)mol,B错误;C、![]() =
=![]() =
=![]() ,随着HCl的不断通入,醋酸的浓度逐渐增大,所以
,随着HCl的不断通入,醋酸的浓度逐渐增大,所以![]() 不断减小,C正确;D、当n(HCl)=0.1mol时,醋酸钠与盐酸恰好转化为醋酸和氯化钠,因此溶液中c(Cl-)>c(CH3COOH)>c(H+),D正确。答案选B。
不断减小,C正确;D、当n(HCl)=0.1mol时,醋酸钠与盐酸恰好转化为醋酸和氯化钠,因此溶液中c(Cl-)>c(CH3COOH)>c(H+),D正确。答案选B。

 阅读快车系列答案
阅读快车系列答案【题目】I.已知:反应
4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ΔH = —115.6 kJ/mol
2Cl2(g)+2H2O(g) ΔH = —115.6 kJ/mol
H2(g) + Cl2(g) = 2HCl(g) ΔH = —184 kJ/mol
H2O(g) = H2O(l) ΔH = —44 kJ/mol
写出H2燃烧热的热化学方程式 。
II.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:![]() ,它所对应的化学方程式为:
,它所对应的化学方程式为:
(2)在一定体积的密闭容器中,进行如下化学反应:
A(g) + 3B(g)![]() 2C(g) + D(s) ΔH,其化学平衡常数K与温度T的关系如下表:
2C(g) + D(s) ΔH,其化学平衡常数K与温度T的关系如下表:
T/K | 300 | 400 | 500 | … |
K/(mol·L-1)2 | 4×106 | 8×107 | K1 | … |
请完成下列问题:
①判断该反应的ΔH 0(填“>”或“<”)
②在一定条件下,能判断该反应一定达化学平衡状态的是 (填序号)。
A.3v(B)(正)=2v(C)(逆) B.A和B的转化率相等
C.容器内压强保持不变 D.混合气体的密度保持不变
(3)已知N2 (g)+ 3H2(g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
①在一定温度下,向容积不变(始终为10L)的密闭容器中加入2 mol N2、8 mol H2 及固体催化剂。10分钟后反应达到平衡状态,容器内气体压强变为起始的80%,此时氨气的体积分数为: ,用氮气表示的反应速率为: 。
②保持①中的温度和容积不变,设a、b、c分别代表初始加入的N2、H2、NH3的物质的量,若反应达平衡后,混合气体中NH3的体积分数与①中的相同,那么: 若a= 0.5,c= 3,则b= ,在此情况下反应起始时将向 反应方向进行。
③保持①中的温度和容积不变,若按下列四种配比作为起始物质,达平衡后容器内N2的转化率大于①中的是 。(填序号)
A.4molNH3 B.1.5molN2、7.5molH2和1molNH3
C.1molN2、5molH2和2molNH3 D.1molN2、6molH2和2molNH3
(4)以天然气(假设杂质不参与反应)为原料的燃料电池示意图如图所示。
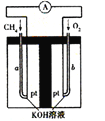
①放电时,负极的电极反应式为 。
②假设装置中盛装100.0 mL 3.0 mol·L-1 KOH溶液,放电时参与反应的氧气在标准状况下体积为8960 mL。放电完毕后,电解质溶液中的溶质是 电解质溶液中各离子浓度的大小关系为 。