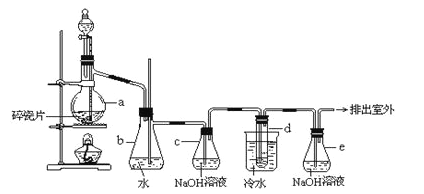
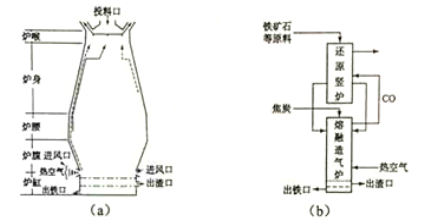
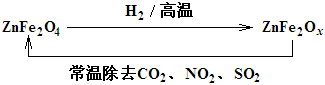
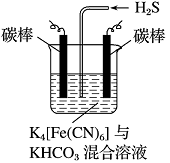
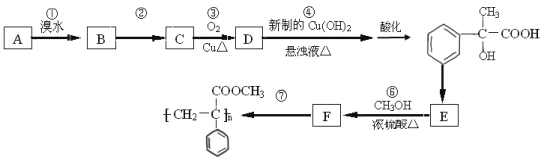
��Ŀ����
����Ŀ�����������������Ƚ������ⷽ������������������������������Ӧϵͳͬʱͨ����顢������ˮ��������������Ҫ��ѧ��Ӧ�У�
��Ӧ | ��ѧ����ʽ | �ʱ���H | ����Ӧ���Ea |
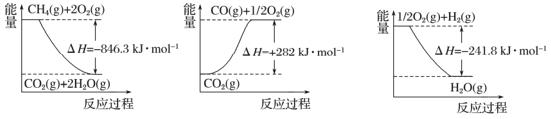
���� | CH4��g����2O2��g����CO2��g����2H2O��g�� | ��802��6 | 125��6 |
CH4��g����O2��g����CO2��g����2H2��g�� | ��322��0 | 172��5 | |
���� | CH4��g����H2O��g����CO��g����3H2��g�� | 206��2 | 240��1 |
CH4��g����2H2O��g����CO2��g����4H2��g�� | 165��0 | 243��9 |
�ش��������⣺
��1����ӦCO��g����H2O��g����CO2��g����H2��g������H= kJ/mol��
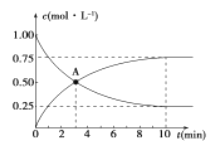
��2���ڳ�ʼ��,�������������ķ�Ӧ���� ���������ķ�Ӧ���ʣ�����ڡ�С�ڻ���ڣ���
��3���������෴Ӧ����ij��֣�B����ƽ��ѹǿ��PB���������ʵ���Ũ�ȣ�cB��Ҳ�ɱ�ʾƽ�ⳣ��������KP������ӦCH4��g����H2O��g��![]() CO��g����3H2��g��KP�ı���ʽΪ �������¶ȵ����ߣ���ƽ�ⳣ�� ������������������С����������������
CO��g����3H2��g��KP�ı���ʽΪ �������¶ȵ����ߣ���ƽ�ⳣ�� ������������������С����������������
��4���������Ƕȷ������������������������Ƚ�֮������ ��
��5����ijһ�������ϱȵ�����£��¶ȡ�ѹǿ��H2��CO���ʵ���������Ӱ������ͼ��
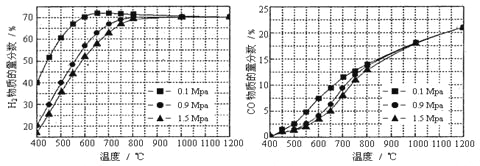
����Ҫ�ﵽH2���ʵ�������>65%/span>��CO�����ʵ�������<10%����������������ʵ��� ��
A��600����0.9Mpa B��700����0.9Mpa C��800����1.5Mpa D��1000����1.5MPa
������600����0��1Mpa�����£�ϵͳ��H2���ʵ��������淴Ӧʱ�䣨�ӳ��½��Ͽ�ʼ��ʱ���ı仯����ʾ��ͼ��
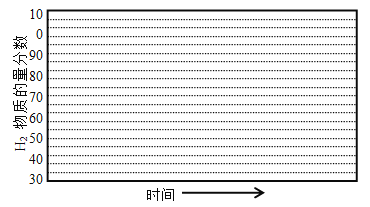
��6������������������������յ���H2���ʵ����������ͣ�ԭ���� ��
���𰸡���1����41��2
��2����
��3��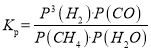 ������
������
��4��ϵͳ��ǿ���ȵļ���������ӦΪǿ���ȵ�����������Ӧ�ṩ�����������
��5����B�� ��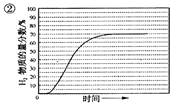
��6�����������̶ȹ��ߣ�������������Ӧ
�������������������1�����ݸ�˹���ɣ�������������������ӦCH4(g)+2H2O��g��=CO2��g��+4H2��g����CH4��g��+H2O��g��= CO��g��+3H2��g�����ɵ÷�ӦCO��g��+H2O��g��=CO2��g��+H2��g��������H="165.0kJ/mol-206.2kJ/mol" =-41.2kJ/mol��
��2���ɱ������ݿ�֪�����������Ļ�ܵ������������Ļ�ܣ����Խ�ͣ���Ӧ����Խ�죬���Գ�ʼ�Σ��������������ķ�Ӧ����С�ڼ��������ķ�Ӧ���ʡ�
��3������ƽ�ⳣ��K�ı���ʽ����֪��ӦCH4(g)+H2O(g)![]() CO(g)+3H2��g����
CO(g)+3H2��g����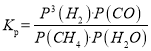 ��
��
�÷�ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ��������Ӧ�����ƶ���ƽ�ⳣ������
��4���������ĽǶȷ������������������������Ƚ�֮������ϵͳ��ǿ���ȵļ���������ӦΪǿ���ȵ�����������Ӧ�ṩ������������������Դ�������ʡ�
��5������ͼ�����ݿ�֪��0.9 MPaʱ��H2�����ʵ�����������65%��CO���ʵ�������С��10%����700�����ϣ�1.5 MPaʱ��H2�����ʵ�����������65%��CO���ʵ�������С��10%�����¶�Ҫ����750��������Լ725����B����ȷ��ACD�����ѡB��
����ʼ����ʱH2�����ʵ�������Ϊ0�����ͼ���֪600����0.1 MPa�������£�ƽ��ʱϵͳ��H2�����ʵ��������ﵽ70%���ݴ˻���H2�����ʵ���������ʱ��仯��ʾ��ͼΪ��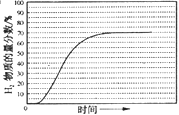 ��
��
��6���������������������ʹ���������̶ȹ��ߣ�������������Ӧ�����������������������͡�

����Ŀ��I����֪����Ӧ
4HCl(g)+O2(g) ![]() 2Cl2(g)+2H2O(g) ��H = ��115.6 kJ/mol
2Cl2(g)+2H2O(g) ��H = ��115.6 kJ/mol
H2(g) + Cl2(g) = 2HCl(g) ��H = ��184 kJ/mol
H2O(g) = H2O(l) ��H = ��44 kJ/mol
д��H2ȼ���ȵ��Ȼ�ѧ����ʽ ��
II��ʵʩ�Լ�����Դ�˷Ѻͽ��ͷ����ŷ�Ϊ�������ݵĽ��ܼ������ߣ���Ӧ��ȫ���������⡢������Դ��Լ�͡������Ѻ������ı�Ȼѡ������ҵ�ķ�չ������Ϲ��ҽ��ܼ��ŵ�����Ҫ����������ѧ֪ʶ������������⣺
��1����֪ij��Ӧ��ƽ�����ʽΪ��![]() ��������Ӧ�Ļ�ѧ����ʽΪ��
��������Ӧ�Ļ�ѧ����ʽΪ��
��2����һ��������ܱ������У��������»�ѧ��Ӧ��
A(g) + 3B(g)![]() 2C(g) + D��s�� ��H���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
2C(g) + D��s�� ��H���仯ѧƽ�ⳣ��K���¶�T�Ĺ�ϵ���±���
T/K | 300 | 400 | 500 | �� |
K/(mol��L��1)2 | 4��106 | 8��107 | K1 | �� |
������������⣺
���жϸ÷�Ӧ�Ħ�H 0���>����<����
����һ�������£����жϸ÷�Ӧһ���ﻯѧƽ��״̬���� ������ţ���
A��3v(B)������=2v(C)���棩 B��A��B��ת�������
C��������ѹǿ���ֲ��� D�����������ܶȱ��ֲ���
��3����֪N2 (g)+ 3H2(g)![]() 2NH3(g) ��H<0
2NH3(g) ��H<0
����һ���¶��£����ݻ����䣨ʼ��Ϊ10L�����ܱ������м���2 mol N2��8 mol H2 �����������10���Ӻ�Ӧ�ﵽƽ��״̬������������ѹǿ��Ϊ��ʼ��80������ʱ�������������Ϊ�� ���õ�����ʾ�ķ�Ӧ����Ϊ�� ��
�ڱ��֢��е��¶Ⱥ��ݻ����䣬��a��b��c�ֱ������ʼ�����N2��H2��NH3�����ʵ���������Ӧ��ƽ����������NH3�������������е���ͬ����ô�� ��a= 0.5��c= 3����b= ���ڴ�����·�Ӧ��ʼʱ���� ��Ӧ������С�
�۱��֢��е��¶Ⱥ��ݻ����䣬�����������������Ϊ��ʼ���ʣ���ƽ���������N2��ת���ʴ��ڢ��е��� ��������ţ�
A��4molNH3 B��1.5molN2��7.5molH2��1molNH3
C��1molN2��5molH2��2molNH3 D��1molN2��6molH2��2molNH3
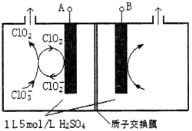
��4������Ȼ��(�������ʲ����뷴Ӧ)Ϊԭ�ϵ�ȼ�ϵ��ʾ��ͼ��ͼ��ʾ��
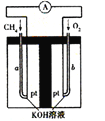
�ٷŵ�ʱ�������ĵ缫��ӦʽΪ ��
�ڼ���װ����ʢװ100.0 mL 3.0 mol��L-1 KOH��Һ���ŵ�ʱ���뷴Ӧ�������ڱ�״�������Ϊ8960 mL���ŵ���Ϻ������Һ�е������� �������Һ�и�����Ũ�ȵĴ�С��ϵΪ ��