题目内容
【题目】人们应用原电池原理制作了多种电池以满足不同的需要。电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染。请根据题中提供的信息,回答下列问题:
(1)研究人员最近发明了一种“水”电池,这种电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2 +2Ag+2NaCl=Na2Mn5O10 +2AgCl
①该电池的负极反应式是______________;
②在电池中,Na + 不断移动到“水”电池的_______极(填“正“或“负”);
③外电路每通过4mol电子时,生成Na2 Mn5 O10 的物质的量是_______。
(2)中国科学院应用化学研究所在甲醇(CH3OH是一种可燃物)燃料电池技术方面获得新突破。甲醇燃料电池的工作原理如下图所示:
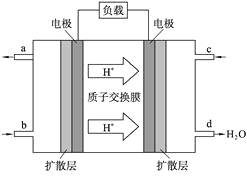
①该电池工作时,b口通入的物质为____________。
②该电池负极的电极反应式 。
③工作一段时间后,当6.4 g甲醇完全反应生成CO2时,有___________NA个电子转移。
(3)Ag2O是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液时,电池放电时正极的Ag2O转化为Ag,负极的Zn转化为Zn(OH)2,写出该电池反应方程式: 。
【答案】(1)①Ag—e-+Cl-=AgCl ; ②正; ③2mol;
(2)①CH3OH;②CH3OH—6e-+H2O=CO2+6H+ ;③1.2;
(3)Ag2O+Zn+H2O=2Ag+Zn(OH)2
【解析】
试题分析:(1) “水”电池能利用淡水与海水之间含盐量的差别进行发电,在海水中电池反应可表示为:5MnO2 +2Ag+2NaCl=Na2Mn5O10 +2AgCl 。①根据反应方程式中元素的化合价的变化可知,Ag失去电子,被氧化,所以作负极,该电池的负极反应式是Ag—e-+Cl-=AgCl;②根据同种电荷相互排斥,一中电荷相互吸引的原则,在电池中,Na + 不断移动到“水”电池的正极MnO2;③根据总反应方程式可知:每转移2mol电子,会产生1mol Na2Mn5O10,则外电路每通过4mol电子时,生成Na2Mn5O10 的物质的量是2mol;(2)①根据示意图可知,溶液中的H+向右移动,则右边的电极为正极,左边的电极为负极。在该电池工作时,b口通入的物质为燃料CH3OH;②该电池负极就是通入甲醇的电极,该电极反应式是CH3OH—6e-+H2O=CO2+6H+ ;③6.4 g甲醇的物质的量是n=6.4g÷32g/mol=0.2mol,每1mol甲醇反应,转移6mol电子,则0.2mol甲醇反应生成CO2时,会转移0.2mol ×6=1.2mol电子。(3)Ag2O是银锌碱性电池的正极活性物质,当银锌碱性电池的电解质溶液为KOH溶液时,电池放电时,正极的Ag2O转化为Ag,电极反应式是:Ag2O+2e-+H2O=2Ag+2OH-,负极的Zn转化为Zn(OH)2,负极的电极反应式是:Zn-2e-+2OH-=Zn(OH)2,则该电池反应方程式是Ag2O+Zn+H2O=2Ag+Zn(OH)2。

 名校课堂系列答案
名校课堂系列答案