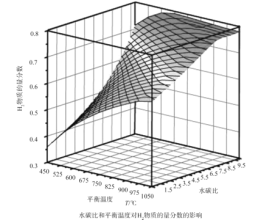
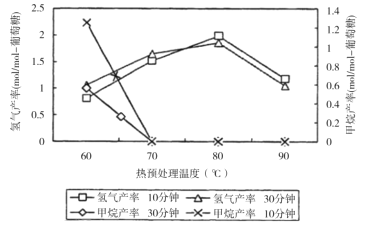
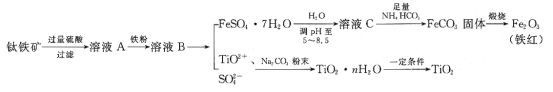
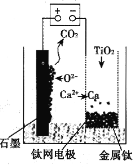
��Ŀ����
����Ŀ���̷�(FeSO4��7H2O)����Ȼ����ڵ�һ�ֿ�ʯ�������籦ʯ��������������ǵ����ӡ�
����һ ���Ʊ��ݡ��͡��칤����ȹż��������й�������ܱ����̷��Ʊ�����(��Ҫ�ɷ���Fe2O3)��������ɫ���ޣ��ȶ��������й���ͳ��ɫ���ϵ���Ҫ��ɫ����
���϶� ��Ԫ8���ͣ�����������Ҳ�ȶ�����������̷����տ�����������������������бȽϴ���ܽ������̷�������һ����������Ĺ��Ϸ�����
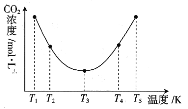
��1��ij�о���ѧϰС������ͼ��ʾ����װ�ö��̷��ı��շ�Ӧ����̽����
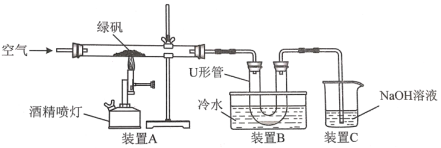
��ʵ������У�װ��A�����пɹ۲쵽��ʵ��������__��
��װ��C��������__��
�۸�С��ѧ���������ʵ�鷽����֤����������������Һ��ȡU�ι��е���Һ�������Թ��У�����__(���Լ�����)����Һ�ʺ�ɫ��˵�����������к���H�����������������к���SO42-�ķ�����__��
��2��ij�����ƻ����̷����չ��������ߴ�������(Fe2O3)160kg�����������������̷���������д��������̡�___��
���𰸡���ɫ��������ɫ��ĩ ����β��SO2����ֹ��Ⱦ���� ��ɫʯ����Һ ȡ��ȴҺ�������Թ��У��μ�ϡ���ᣬû�������ټ����Ȼ�����Һ������а�ɫ�������ɣ�˵������SO42- 278kg
��������
��1�������ݷ�Ӧ����������ж�����
�ڶ���������Ⱦ���������������ŷţ���������������Һ�����ã�
�����ݳ��������Ӻ������Ӽ��鷽��������
��2������ԭ���غ���м��㡣
��1���ٱ����̷��Ʊ�����(��Ҫ�ɷ���Fe2O3)��ʵ������У�װ��A�����пɹ۲쵽��ʵ����������ɫ��������ɫ��ĩ��
�ʴ�Ϊ����ɫ��������ɫ��ĩ��
���ڿ����м����̷��������ɶ����������������Ⱦ���������������ŷţ��������������ն�������ֹ��Ⱦ������
�ʴ�Ϊ������β��SO2����ֹ��Ⱦ������
�ۼ�������������ɫʯ����Һ����Һ���ɫ���������������к���SO42-�ķ�����ȡ��ȴҺ�������Թ��У��μ�ϡ���ᣬû�������ټ����Ȼ�����Һ������а�ɫ�������ɣ�˵������SO42-��
�ʴ�Ϊ����ɫʯ����Һ��ȡ��ȴҺ�������Թ��У��μ�ϡ���ᣬû�������ټ����Ȼ�����Һ������а�ɫ�������ɣ�˵������SO42-��
��2��������ԭ���غ�ã�m���̷���=![]() ��2��M(�̷�)=
��2��M(�̷�)=![]() ��2��278g/mol=278kg���ʴ�Ϊ��278kg��
��2��278g/mol=278kg���ʴ�Ϊ��278kg��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ�����ֶ�����Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼ����±�����֪X�Ƕ�����������õĽ���������Rͬ���ڡ�(���û�ѧ�������)
Ԫ�ش��� | X | Y | Z | M | R |
ԭ�Ӱ뾶/nm | 0.186 | 0.102 | 0.075 | 0.074 | 0.143 |
��Ҫ���ϼ� | ��1 | ��6 ��2 | ��5 ��3 | ��2 | ��3 |
��1��R��Ԫ�ط���Ϊ___��M��Ԫ�����ڱ��е�λ��Ϊ___��
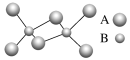
��2��X��Y��ԭ�Ӹ�����1��1���ɵ����ʵĵ���ʽΪ___��������ѧ������___��
��3��X����Y2-��M2-���Ӱ뾶��С˳��Ϊ___��
��4����YM2ͨ��FeCl3��Һ�е����ӷ���ʽ��___��
����Ŀ�������л���ѧ��Ӧ����ʽ����Ӧ���;���ȷ����
ѡ�� | ��ѧ��Ӧ����ʽ | ��Ӧ���� |
A | CH3COOH��CH3CH2OH | ������Ӧ |
B | CH4��Cl2 | �û���Ӧ |
C | CH2=CH2��Br2 CH3CHBr2 | �ӳɷ�Ӧ |
D |
| ȡ����Ӧ |
A. A B. B C. C D. D