题目内容
【题目】甲烷水蒸气的重整反应是工业制备氢气的重要方式,其化学反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列问题:
CO(g)+3H2(g)。回答下列问题:
(1)已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1
CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1
O2(g)=CO(g) H2=-283.0kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1
O2(g)=H2O(l) H3=-285.8kJmol-1
CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1
则甲烷水蒸气重整反应的△H=__kJ·mol-1。
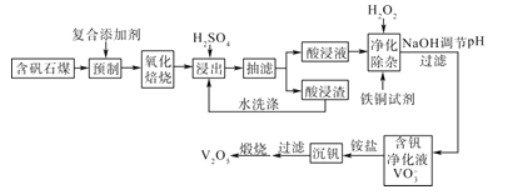
(2)通过计算机模拟实验,对400~1200℃、操作压强为0.1MPa条件下,不同水碳比(1~10)进行了热力学计算,反应平衡体系中H2的物质的量分数与水碳比、平衡温度的关系如图所示。
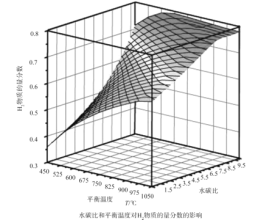
①H2的物质的量分数与水碳比(1~10)的关系是平衡温度一定时,__;其原因是__。
②据模拟实验可知,平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率为__,其压强平衡常数为__;反应速率方程为v=kp(CH4)p-1(H2),此时反应速率=__(已知:气体分压=气体的物质的量分数×总压,速率方程中k为速率常数)。
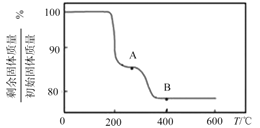
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时不同热预处理温度和时间下的甲烷和氢气的产率如图所示,若要提高H2的产率,最佳温度为__;与甲烷水蒸气重整制氢相比其优点有__(至少写两点)。
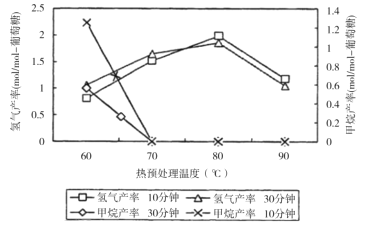
【答案】+206.3 水碳比越大,H2的物质的量分数越大 水碳比较大时,CO会与H2O进一步反应生成H2,使H2的物质的量分数增大 66.67% 4.32×102(MPa)2 ![]() 80℃ 原料来源广、制取H2温度低、不会产生CO等有害气体等
80℃ 原料来源广、制取H2温度低、不会产生CO等有害气体等
【解析】
(1)用盖斯定律求甲烷水蒸气重整反应的△H;
(2)①H2的物质的量分数与水碳比(1~10)的关系由图知;原因从生成氢气的反应角度来回答;
②平衡温度为900℃,水碳比为1.0时,H2的物质的量分数为0.6,CH4的转化率、其压强平衡常数;以及此时反应速率通过三段式计算;
(3)厌氧细菌可将葡萄糖转化为CH4和H2,提高H2的产率的最佳温度,由图知;与甲烷水蒸气重整制氢相比的优点从反应的难易程度及环保、经济等角度来考察。
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) H1=-890.3kJ·mol-1②CO(g)+![]() O2(g)=CO(g) H2=-283.0kJ·mol-1③H2(g)+
O2(g)=CO(g) H2=-283.0kJ·mol-1③H2(g)+![]() O2(g)=H2O(l) H3=-285.8kJmol-1④CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1,根据盖斯定律,①+④2×②2×③即得甲烷水蒸气的重整反应方程式为CH4(g)+H2O(g)
O2(g)=H2O(l) H3=-285.8kJmol-1④CO(g)+H2O(g)=CO2(g)+H2(g) H4=-41.0kJmol-1,根据盖斯定律,①+④2×②2×③即得甲烷水蒸气的重整反应方程式为CH4(g)+H2O(g)![]() CO(g)+3H2(g),则甲烷水蒸气重整反应ΔH=ΔH1+ΔH42ΔH22ΔH3=(890.341+2×283.0+2×285.8) kJmol1=+206.3 kJmol1;
CO(g)+3H2(g),则甲烷水蒸气重整反应ΔH=ΔH1+ΔH42ΔH22ΔH3=(890.341+2×283.0+2×285.8) kJmol1=+206.3 kJmol1;
答案为:+206.3;
(2)①平衡温度一定时,H2的物质的量分数与水碳比(1~10)的关系,由图中曲线走势可知;
答案为:水碳比越大,H2的物质的量分数越大;
水碳比越大,H2的物质的量分数越大的原因,从生成氢气的反应可知,除了甲烷水蒸气的重整反应生成氢气外,一氧化碳和水也会反应产生氢气;
答案为:当水碳比较大时,CO会与H2O反应生成H2,使H2的物质的量分数增大;
②操作压强为0.1MPa、平衡温度为900℃条件下,水碳比为1.0时,H2的物质的量分数为0.6,设甲烷和H2O的物质的量均为amol,达化学平衡时,甲烷消耗x,
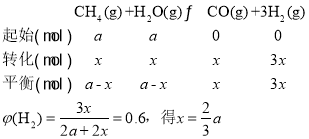 ,则CH4的转化率
,则CH4的转化率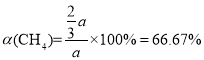
答案为:66.67%;
已知:气体分压=气体的物质的量分数×总压,
![]() ,
,![]() ,压强平衡常数为
,压强平衡常数为![]() ;
;
答案为:4.32×102(MPa)2;
反应速率方程为v=kp(CH4)p-1(H2),此时反应速率![]() ;
;
答案为:![]() ;
;
(3)厌氧细菌可将葡萄糖转化为CH4和H2,pH为5.5时,若要提高H2的产率,降低甲烷产率,最佳温度为80℃;与甲烷水蒸气重整制氢相比其优点有原料来源广、制取H2温度低、不会产生CO等有害气体等;
答案为:80℃;原料来源广、制取H2温度低、不会产生CO等有害气体等。