题目内容
【题目】工业、上常用钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]作原料,制取二氧化钛及铁红,其生产流程如图:
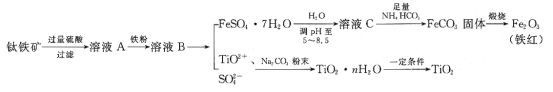
已知:TiO2+易水解,只能存在于强酸性溶液中。
回答下列问题:
(1)钛铁矿用硫酸溶解时,过滤所得滤渣的成分是__(填化学式)。
(2)从溶液B中得到FeSO4·7H2O晶体的操作是__、过滤、洗涤、干燥。
(3)溶液C中加入NH4HCO3,发生反应的离子方程式是__。
(4)煅烧FeCO3,发生反应的化学方程式是__。
(5)流程中加入Na2CO3粉末得到固体TiO2·nH2O。请结合TiO2+的水解平衡原理解释其原因:__。
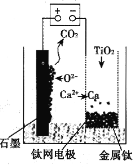
(6)用如图所示装置(熔融CaF2-CaO作电解质)获得金属钙,并用钙还原TiO2制取金属钛。阳极反应式是__,反应过程中CaO的物质的量__(填“减小”“不变”或“增大”)。
【答案】SiO2 蒸发浓缩、冷却结晶 Fe2++2HCO3 =FeCO3↓+CO2↑+H2O 4FeCO3+O2![]() 2Fe2O3+4CO2 TiO2++(n+1)H2OTiO2·nH2O+2H+,加入Na2CO3粉末消耗H+,平衡正向移动,生成TiO2·nH2O C+2O2-4e===CO2↑ 不变
2Fe2O3+4CO2 TiO2++(n+1)H2OTiO2·nH2O+2H+,加入Na2CO3粉末消耗H+,平衡正向移动,生成TiO2·nH2O C+2O2-4e===CO2↑ 不变
【解析】
钛铁矿[主要成分为FeTiO3(钛酸亚铁,不溶于水)、Fe2O3及少量SiO2杂质]加过量硫酸,FeTiO3溶于过量硫酸,生成Fe2+、TiO2+、H2O,Fe2O3溶于过量硫酸,生成Fe3+离子,SiO2杂质不溶于酸,滤液A主要阳离子为Fe2+、TiO2+、Fe3+;加入铁粉,发生了反应:2Fe3++Fe═3Fe2+,溶液B主要阳离子为Fe2+ 、TiO2+,蒸发浓缩冷却结晶得绿矾和TiO2+、SO42-,加入碳酸钠粉末生成TiO2nH2O,一定条件下得到TiO2;绿矾加水溶解,调节pH至5~8.5防止水解,溶液C溶质主要为FeSO4,加入足量的NH4 HCO3,生成FeCO3,经过煅烧后得到Fe2O3 。
(1)根据分析可知滤渣主要为不溶于酸的SiO2;
(2)从溶液中得到晶体的一般操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥;
(3)加入碳酸氢铵后,Fe2+与碳酸氢根电离出的碳酸根结合生成碳酸亚铁沉淀,促进碳酸氢根的电离,氢离子浓度增大,氢离子浓度增大后又促进碳酸氢根的水解,生成二氧化碳,所以离子方程式为:Fe2++2HCO3 =FeCO3↓+CO2↑+H2O;
(4)煅烧FeCO3生成三氧化二铁和二氧化碳,Fe2+别氧化,结合元素守恒可知氧化剂为O2,根据电子守恒可得方程式为:4FeCO3+O2![]() 2Fe2O3+4CO2;
2Fe2O3+4CO2;
(5)溶液中存在平衡TiO2++(n+1)H2OTiO2·nH2O+2H+,加入Na2CO3粉末消耗H+,平衡正向移动,生成TiO2·nH2O;
(6)与正极相连的是阳极,据图可知石墨电极为阳极,反应过程中C被氧化生成CO2,所以电极方程式为:C+2O2-4e===CO2↑;阴极上电极反应式为:2Ca2++4e-═2Ca,钙还原二氧化钛反应方程式为:2Ca+TiO2=Ti+2CaO,在制备金属钛前后,整套装置中CaO的总量不变。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案