题目内容
【题目】新技术的开发应用,不仅有利于改善环境质量,而且能充分开发“废物”的潜在价值。
回答下列问题:
(1)用烟道气与氢气来合成甲醇涉及到如下几个反应:
①CO(g)+2H2(g)=CH3OH(g) △H=-91kJ·mol-1
②2CO2(g)=2CO(g)+O2(g) △H=+566kJ·mol-1
③2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
④CO2(g)+3H2(g)=CH3OH(g)+H2O(g)H=__kJ·mol-1。
(2)在容积均为2L的两个恒容密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g),有关数据如下:
CO2(g)+H2(g),有关数据如下:

①800°C时该反应的平衡常数K=__。
②容器2中x=__,n=___。
③若800℃起始时,在2L恒容密闭容器中加入CO、H2O、CO2、H2各1mol,则此时v正__v逆(填“>”“<”或“=”)。
(3)反应(NH4)2CO3+H2O+CO2![]() 2NH4HCO3OH可用于捕捉空气中的CO2,为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定CO2气体的浓度,得到的曲线图如图:
2NH4HCO3OH可用于捕捉空气中的CO2,为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体,在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测定CO2气体的浓度,得到的曲线图如图:
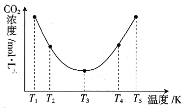
①H__0(填“>”“<”或“=”)。T1~T2区间,c(CO2)变化的原因是___。
②已知常温下NH3·H2O的电离常数K=1.8×10-5,碳酸的电离常数K1=4.4×10-7、K2=4.7×10-11,则恰好完全反应时所得的NH4HCO3溶液中c(H+)__c(OH-)(填“>”“<”或“=”)。
③在图中所示五种温度下,该反应的平衡常数最大的温度是__。
【答案】-49.8 1 ![]()
![]() 或66.7% = < T1~ T2区间,反应未平衡,温度上升反应速率加快,相同时间内捕捉的CO2越多,剩余的二氧化碳浓度就越小 < T1
或66.7% = < T1~ T2区间,反应未平衡,温度上升反应速率加快,相同时间内捕捉的CO2越多,剩余的二氧化碳浓度就越小 < T1
【解析】
(1))已知①CO(g)+2H2 (g)═CH3OH(g)△H=-91kJmol-1
②2CO2 (g)═2CO(g)+O2(g)△H=+566.0 kJmol-1
③2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJmol-1 .
由盖斯定律可知,①+![]() (②+③)得CO2(g)+3H2(g)═CH3OH(g)+H2O(g),△H=-91kJmol-1 +
(②+③)得CO2(g)+3H2(g)═CH3OH(g)+H2O(g),△H=-91kJmol-1 +![]() ×(566.0 kJmol-1-483.6 kJmol-1 )=-49.8kJmol-1;
×(566.0 kJmol-1-483.6 kJmol-1 )=-49.8kJmol-1;
(2)①容器体积为2L,所以初始c(CO)=![]() ,c(H2)=
,c(H2)=![]() ;平衡时CO的转化率为
;平衡时CO的转化率为![]() ,即转化
,即转化![]() mol·L-1,列三段式:
mol·L-1,列三段式:
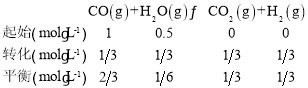
根据平衡常数的概念可知K=![]() =1;
=1;
②达到平衡时氢气的物质的量为nmol,则其浓度c(H2)=![]() ,列三段式有:
,列三段式有:
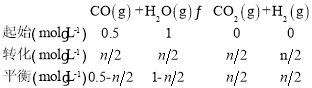
温度不变平衡常数不变,所以平衡常数K=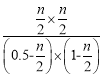 =1,解得n=
=1,解得n=![]() mol,CO的转化率为
mol,CO的转化率为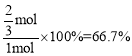 ;
;
③在2 L恒容密闭容器中加入CO、H2O、CO2、H2各1 mol,该反应前后气体系数之和相同,所以可用物质的量代替浓度计算,此时浓度商Q=![]() =K,所以平衡不发生移动,即v正=v逆;
=K,所以平衡不发生移动,即v正=v逆;
(3)①T3温度之前随温度上升,反应速率加快,所以相同时间内测得的CO2浓度下降,T3温度之后,在相同时间内反应已达到平衡,温度上升,平衡左移,CO2浓度上升,说明该反应的正反应为放热反应,即H<0;T1~ T2区间,反应未平衡,温度上升反应速率加快,相同时间内捕捉的CO2越多,剩余的二氧化碳浓度就越小;
②铵根的水解使溶液显酸性,碳酸氢根水解使溶液显碱性,铵根的水解平衡常数Kh=![]() ,碳酸氢根的水解平衡常数Kh=
,碳酸氢根的水解平衡常数Kh=![]() ,比较可知碳酸氢根的水解程度大于铵根的水解程度,所以溶液显碱性,即c(H+)<c(OH- );
,比较可知碳酸氢根的水解程度大于铵根的水解程度,所以溶液显碱性,即c(H+)<c(OH- );
③根据①可知该反应为放热反应,温度越高平衡常数越小,所以T1温度时平衡常数最大。

 阅读快车系列答案
阅读快车系列答案