题目内容
8.下列说法不正确的是( )| A. | 常温下,醋酸钠与醋酸的混合溶液pH=7,c(Na+)=c(CH3COO-) | |
| B. | 0.1 mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| C. | 常温下,将pH=1的醋酸溶液稀释100倍后,水电离的c(H+)=10-11mol/L | |
| D. | 0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
分析 A.混合溶液pH=7,则c(H+)=c(OH-),根据混合液中的电荷守恒判断;
B.根据碳酸钠溶液中的中子数判断;
C.醋酸为弱酸,醋酸中的氢氧根离子是水电离的,稀释后溶液中氢离子浓度大于10-3mol/L,氢氧根离子浓度小于10-11mol/L;
D.根据碳酸氢钠溶液中的电荷守恒判断.
解答 解:A.常温下,醋酸钠与醋酸的混合溶液pH=7,则c(H+)=c(OH-),根据电荷守恒可得:c(Na+)=c(CH3COO-),故A正确;
B.0.1 mol/L Na2CO3溶液中,根据质子守恒可得:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3),故B正确;
C.醋酸属于弱酸,醋酸中的氢氧根离子是水电离的,将pH=1的醋酸溶液稀释100倍后,溶液中氢离子浓度大于10-3mol/L,氢氧根离子浓度小于10-11mol/L,故C错误;
D.0.1mol/L NaHCO3溶液中,根据电荷守恒可得:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-),故D正确;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及酸碱混合的定性判断、盐的水解原理、离子浓度大小比较等知识,明确电荷守恒、物料守恒、质子守恒及盐的水解原理为解答关键.

练习册系列答案
相关题目
19.下列关于钠的叙述错误的是( )
| A. | 实验后剩余的钠粒可放回原试剂瓶中 | |
| B. | 刚刚切开的钠的银白色断面会很快变暗 | |
| C. | 自然界中无游离态的钠存在 | |
| D. | 钠在空气中加热时生成白色的过氧化钠 |
3.下列化学变化中,不能够通过一步反应实现的是( )
| A. | Na→Na2O2 | B. | N2→NH3 | C. | N2→NO2 | D. | Ca(OH)2→NaOH |
13.下列说法不正确的是( )
| A. | 在稀硫酸中加入铜粉,铜粉不溶解,再加入Cu(NO3)2固体,铜粉仍不溶解 | |
| B. | 某气体能使湿润的红色石蕊试纸变蓝,该气体的水溶液一定显碱性 | |
| C. | 浓硝酸与木炭反应的离子方程式:C+4H++4NO3-=CO2↑+4NO2↑+2H2O | |
| D. | HNO3→NO→NO2,以上各步变化均能通过一步实现 |
17.天平两边各放质量相等的烧杯,分别装入等质量,等溶质质量分数的稀硫酸,此时天平平衡,将等质量的MgCO3和Na2CO3分别加入两烧杯中,充分反应后,下列说法错误的是( )
| A. | 若天平不平衡,指针一定偏向加Na2CO3的一边 | |
| B. | 若天平平衡,两烧杯中的酸一定完全反应 | |
| C. | 若反应后Na2CO3有剩余,天平一定平衡 | |
| D. | 若天平不平衡,两种碳酸盐一定都没有剩余 |
18.水的作用与反应Br2+SO2+2H2O═H2SO4+2HBr不相同的是( )
| A. | 2Na2O2+2H2O═4NaOH+O2↑ | B. | 4Fe(OH)2+O2+2H2O═4Fe(OH)3 | ||
| C. | Cl2+H2O═HCl+HClO | D. | 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ |
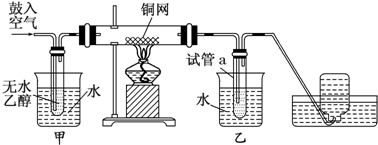
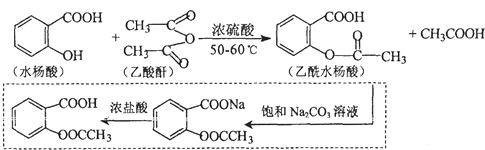
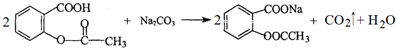
 .
.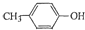 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件: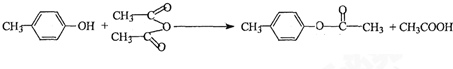 .
.