题目内容
17.天平两边各放质量相等的烧杯,分别装入等质量,等溶质质量分数的稀硫酸,此时天平平衡,将等质量的MgCO3和Na2CO3分别加入两烧杯中,充分反应后,下列说法错误的是( )| A. | 若天平不平衡,指针一定偏向加Na2CO3的一边 | |
| B. | 若天平平衡,两烧杯中的酸一定完全反应 | |
| C. | 若反应后Na2CO3有剩余,天平一定平衡 | |
| D. | 若天平不平衡,两种碳酸盐一定都没有剩余 |
分析 发生反应:MgCO3+H2SO4=MgSO4+H2O+CO2↑,Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,由方程式可知,84gMgCO3反应生成44gCO2,消耗98gH2SO4,而106gNa2CO3反应生成44gCO2,消耗98gH2SO4,故相等质量的MgCO3和Na2CO3完全反应时,MgCO3反应生成的CO2更多,若硫酸均过量时,天平不可能平衡,若硫酸均不足量,生成的CO2质量相等,则天平可以平衡,若碳酸镁与硫酸恰好反应,则硫酸与碳酸钠反应时,硫酸一定有剩余,MgCO3反应生成的CO2更多,天平不可能平衡,若硫酸与碳酸钠恰好反应,则与碳酸镁反应时,硫酸不足,生成的CO2质量相等,天平不可能平衡.生成二氧化碳多的一端,该端溶液与烧杯总质量越小,进而判断天平转化偏转方向.
解答 解:MgCO3+H2SO4=MgSO4+H2O+CO2↑
84g 98g 44g
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106g 98g 44g
故相等质量的MgCO3和Na2CO3完全反应时,MgCO3反应生成的CO2更多,则:
若硫酸均过量时,天平不可能平衡,指针偏向加Na2CO3的一边;
若硫酸均不足量,生成的CO2质量相等,则天平可以平衡;
若碳酸镁与硫酸恰好反应,则硫酸与碳酸钠反应时,硫酸一定有剩余,MgCO3反应生成的CO2更多,指针偏向加Na2CO3的一边;
若硫酸与碳酸钠恰好反应,则与碳酸镁反应时,硫酸不足,生成的CO2质量相等,天平不可能平衡,指针偏向加MgCO3的一边;
A.由上述分析可知:若天平不平衡,指针偏向加Na2CO3的一边,故A正确;
B.由上述分析可知,若天平平衡,两烧杯中的酸一定完全反应,故B正确;
C.由上述分析可知,若反应后Na2CO3有剩余,则MgCO3一定有剩余,生成的CO2质量相等,天平一定平衡,故C正确;
D.由上述分析可知,若天平不平衡,可能碳酸镁有剩余,而碳酸钠完全反应,故D错误,
故选:D.
点评 本题以天平平衡为载体考查过量计算,属于讨论型题目,侧重考查学生分析计算能力,关键是根据方程式讨论可能的情况,难度中等.

| A. | 将铜丝插入浓硫酸加热,反应后把水加入反应器中,观察硫酸铜溶液的颜色 | |
| B. | 常温下将铜丝伸入盛满氯气的集气瓶中,观察CuCl2的生成 | |
| C. | 金属钠放入硫酸铜溶液中可以置换出金属铜 | |
| D. | 将表面有铜绿[Cu2(OH)2CO3]的铜器放入盐酸中浸泡,除去铜绿 |
| A. | 常温下,醋酸钠与醋酸的混合溶液pH=7,c(Na+)=c(CH3COO-) | |
| B. | 0.1 mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| C. | 常温下,将pH=1的醋酸溶液稀释100倍后,水电离的c(H+)=10-11mol/L | |
| D. | 0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
| A. | 聚氯乙烯分子中含碳碳双键 | B. | 以淀粉为原料可制取乙酸乙酯 | ||
| C. | 戊烷有3种同分异构体 | D. | 油脂的皂化反应属于水解反应 |
| 甲烷 | 乙烷 | 丙烷 | 丁烷 | 戊烷 | |
| 分子式 | CH4 | C2H6 | C3H8 | C4H10 | C5H12 |
结构式 | 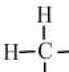 | 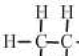 | 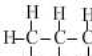 |  | 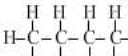 |
| A. | 3:7 | B. | 44:21 | C. | 6:7 | D. | 11:12 |
| A. | 氧化物 | B. | 有机物 | C. | 金属或合金 | D. | 酸、碱、盐 |