题目内容
9.反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在2L的密闭容器中进行,1min后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )| A. | NO:0.06mol•L-1 | B. | H2O:0.002mol•L-1 | ||
| C. | NH3:0.002mol•L-1 | D. | O2:0.00125mol•L-1 |
分析 根据△c=$\frac{△n}{V}$计算△c(NH3),再利用浓度变化量之比等于化学计量数之比计算.
解答 解:由1分钟后,NH3减少了0.12摩尔,则每秒钟内△c(NH3)=$\frac{\frac{0.12mol}{60}}{2L}$=0.001mol/L,
浓度变化量之比等于化学计量数之比,则:
△c(NO)=△c(NH3)=0.001mol/L,
△c(H2O)=$\frac{6}{4}$△c(NH3)=$\frac{6}{4}$×0.001mol/L=0.0015mol/L,
△c(O2)=$\frac{5}{4}$△c(NH3)=$\frac{5}{4}$×0.001mol/L=0.00125 mol/L,
故选D.
点评 本题考查化学反应速率的有关计算,注意根据速率定义式理解速率规律,有利于基础知识的巩固.

练习册系列答案
相关题目
1.下列各组粒子中,互为同位素的是( )
| A. | H T | B. | O2 O3 | C. | 红磷 白磷 | D. | H2 D2 |
14.下列各组物质互为同系物的是( )
① 与
与
②HCHO与CH3CH2CHO
③CH4与C3H8
④1-丁烯与2-甲基丙烯
⑤ 与
与
⑥乙醇与乙二醇.
①
 与
与
②HCHO与CH3CH2CHO
③CH4与C3H8
④1-丁烯与2-甲基丙烯
⑤
 与
与
⑥乙醇与乙二醇.
| A. | ①④⑤ | B. | ①④⑥ | C. | ②③⑤ | D. | ④⑤⑥ |
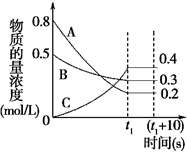 在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题:
在一定条件下,A气体与B气体反应生成C气体.反应过程中,反应物与生成物的浓度随时间变化的曲线如图.回答下列问题: 可命名为2,2,4,4,5-五甲基-3,3-二乙基己烷.
可命名为2,2,4,4,5-五甲基-3,3-二乙基己烷.