题目内容
已知Ksp(BaSO4 )= 1.1×10-10,Ksp(BaCO3)=2.5×10-9。下列说法中不正确的是
| A.BaSO4比BaCO3溶解度小,所以,BaCO3可以转化为BaSO4 |
| B.BaCO3、BaSO4均不溶于水,所以都可以做钡餐试剂 |
| C.向Na2CO3溶液中加入BaCl2和Na2SO4,当两种沉淀共存时,c(SO42—)/ c(CO32—) =4.4×10-2 |
| D.常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于2.2×10-6 mol·L-1 |
B
解析试题分析:A、难溶的可以转化成更难溶的,故A正确;B、碳酸钡能溶于胃酸生成钡离子,引起重金属中毒,故B错误;C、当向溶液中加入BaCl2和Na2SO4时,溶液中Ba2+浓度相等,根据溶度积常数可以求出,当两种沉淀共存时Ksp(BaSO4 )÷Ksp(BaCO3)=c(SO42-)/ c(CO32-)=1.1×10-10÷2.5×10-9=4.4×10-2,C正确;根据溶度积常数可知,在碳酸钡溶液中,Ba2+浓度=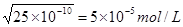 ,所以常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于
,所以常温下,BaCO3若要在Na2SO4溶液中开始转化为BaSO4,则Na2SO4的浓度必须不低于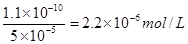 ,D正确;故选B。
,D正确;故选B。
考点:考查难溶电解质的溶解平衡和沉淀转化。

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案
相关题目
下列叙述或表示正确的是
| A.0.1 mol·L-1的醋酸的pH=a,0.01 mol·L-1的醋酸的pH=b,则a+1=b |
| B.用200 mL 4 mol·L-1的NaOH溶液将0.6 mol CO2完全吸收,反应的离子方程式为: 3CO2+4OHˉ=CO32ˉ+2HCO3ˉ+H2O |
| C.难溶电解质AB2的饱和溶液中,c(A2+)=xmol·L-1, c(B-)="y" mol·L-1,则Ksp值为4xy2 |
| D.常温下0.1 mol·L-1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中: |
在室温下,下列叙述正确的是
A.将 的一元酸溶液稀释到 的一元酸溶液稀释到 ,若溶液的 ,若溶液的 ,则此酸为弱酸 ,则此酸为弱酸 |
B.将  盐酸稀释到 盐酸稀释到 ,得到 ,得到 的盐酸 的盐酸 |
C.用 的盐酸分别中和 的盐酸分别中和 溶液和氨水, 溶液和氨水,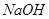 消耗盐酸的体积大 消耗盐酸的体积大 |
D. 的盐酸与 的盐酸与 的硫酸比较, 的硫酸比较, |
下列过程或现象与盐类水解无关的是
| A.纯碱溶液去油污 | B.加热稀醋酸溶液其pH 稍有减小 |
| C.明矾净水 | D.浓的硫化钠溶液有臭鸡蛋气味 |
已知某温度下,Ka (HCN)= 6.2×10-10 mol·L-1、Ka (HF)=" 6.8×10" - 4 mol·L-1、 Ka (CH3COOH)= 1.8×10-5 mol·L-1、Ka (HNO2)=" 6.4×10" - 6 mol·L-1。物质的量浓度都为0.1 mol·L-1的下列溶液中,pH最小的是
| A.HCN溶液 | B.HF溶液 | C.CH3COOH溶液 | D.HNO2溶液 |
在相同的条件下测得①NaHCO3 ②CH3COONa ③NaClO三种溶液pH相同,则它们的物质的量浓度由大到小的顺序是
| A.①>②>③ | B.③>②>① | C.②>①>③ | D.③>①>② |
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
| A.pH=4的醋酸中:c(H+)=4.0mol·L-1 |
| B.饱和小苏打溶液中:c(Na+)= c(HCO3-) |
| C.饱和食盐水中:c(Na+)+ c(H+)= c(Cl-)+c(OH-) |
| D.pH=12的纯碱溶液中:c(OH-)=1.0×10-2mol·L-1 |
在0.1 mol/L的Na2CO3溶液中,下列关系正确的是( )
A.c(Na+)=2c(CO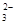 ) ) | B.c(OH-)=2c(H+) |
C.c(HCO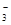 )>c(H2CO3) )>c(H2CO3) | D.c(Na+)<c(CO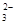 )+c(HCO )+c(HCO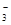 ) ) |