题目内容
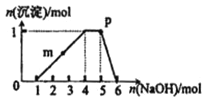
【题目】用过量的H2SO4、NaOH、NH3·H2O、NaCl等溶液,按题图所示步骤分开五种离子。则溶液①、②、③、④是( )
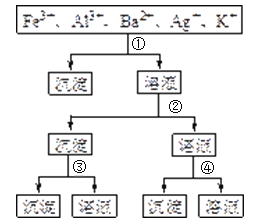
A.①NaCl②NaOH③NH3·H2O④H2SO4
B.①H2SO4②NaOH③NH3·H2O④NaCl
C.①H2SO4②NH3·H2O③NaOH④NaCl
D.①NaCl②NH3·H2O③NaOH④H2SO4
【答案】D
【解析】
从题目所给的图示步骤综合分析,可以看出第①步分离五种离子中的一种离子,只能是Ag+与Cl-结合生成AgCl沉淀。第②步产生的沉淀和剩余的溶液分别分离出两种离子,应用NH3·H2O沉淀出Fe3+和Al3+,然后用强碱NaOH溶液将Fe(OH)3和Al(OH)3分离。第④步用SO42-将Ba2+和K+分离,故答案为D。

练习册系列答案
相关题目