题目内容
【题目】某溶液中可能含有H+、Na+、NH4+、Fe3+、Al3+、SO42-等离子。向该溶液中滴加NaOH溶液,生成沉淀的物质的量变化曲线如图所示。下列有关判断正确的是
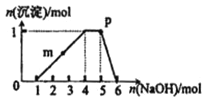
A. m点处反应:H++OH-=H2O
B. p点:c(NH4+)>c(OH-)>c(H+)
C. 若取原溶液做焰色反应实验,焰色应为黄色
D. 原溶液中存在的主要离子:n(H+)=n(NH4+)=n(Al3+)
【答案】D
【解析】根据0~1段,没有生成沉淀,说明一定含有氢离子,酸碱中和反应是一切反应的优先反应,生成沉淀在后面完全溶解,说明一定含有铝离子,肯定不含有Fe3+,根据4~5段,和氢氧化钠反应不产生沉淀,说明一定含有铵根离子;即原溶液中含有的阳离子是H+、NH4+、Al3+,根据溶液电中性可知一定含有硫酸根离子,可能含有钠离子,肯定不含有Fe3+;则A. m点处反应:Al3++3OH-=Al(OH)3↓,A错误;B. p点铵根恰好全部转化为一水合氨:c(OH-)>c(NH4+)>c(H+),B错误;C. 由于钠离子不一定存在,因此若取原溶液做焰色反应实验,焰色不一定为黄色,C错误;D. 根据坐标得与氢离子反应的氢氧化钠为1mol,生成沉淀用了3mol氢氧化钠,与铵根反应用了1mol氢氧化钠,因此原溶液中存在的主要离子:n(H+)=n(NH4+)=n(Al3+),D正确,答案选D。

练习册系列答案
相关题目