题目内容
【题目】第 VIII 族元素,跟主族元素的金属相比,它们有熔、沸点高、硬度高、密度大等特点,并有良好的延展性和高导电、导热性。下列有关它们及其化合物的结构与性质,请填写:
(1)在[Ni(NH3)6]2+中,Ni2+与NH3之间形成的化学键称为________,提供孤对电子的成键原子是________。
(2)①Co元素形成CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)各1mol,分别与足量硝酸银溶液反应,都得到1molAgCl沉淀。两种配合物中配合离子的配位数都是________,CoCl3·4NH3(绿色)和CoCl3·4NH3(紫色)的组成相同而颜色不同的原因是________。
②Co(OH)2为两性氢氧化物,在浓的强碱溶液中可以形成[Co(OH)4]2。写出Co(OH)2酸式电离的电离方程式__________。
(3)与 Co 属于同周期同族的过渡元素A,其基态原子排布中有四个未成对电子。
①由此元素可构成固体X,区别X为晶体或非晶体的方法为______________。
②A可与CO反应生成A(CO) 5 ,常压下熔点为-20.3℃,沸点为103.6℃,该晶体类型是______________。
③A3+与SCN不仅能以1:3的个数比配合,还可以其它个数比配合。若 A3+与SCN以1:4 的个数比配合,则ACl3与KSCN在水溶液中发生反应的化学方程式可表示为_______。
④A 可与另两种元素B、C构成某种化合物,B、C的外围电子排布分别为3d104s1、3s23p4,其晶胞如图所示,则其化学式为_________。
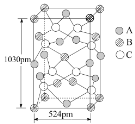
该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度d=__________g﹒cm3。(保留两位小数)
【答案】配位键 N 6 空间结构不同 Co(OH)2+2H2O![]() [Co(OH)4]2+2H+ X-射线衍射 分子晶体 FeCl3+4KSCN=K[Fe(SCN)4]+3KCl CuFeS2 4.32
[Co(OH)4]2+2H+ X-射线衍射 分子晶体 FeCl3+4KSCN=K[Fe(SCN)4]+3KCl CuFeS2 4.32
【解析】
(1)在[Ni(NH3)6]2+中,Ni2+离子具有空轨道,NH3分子中N原子具有孤对电子,Ni2+与NH3之间能形成配位键;
(2)①1molCOCl34NH3(绿色)和CoCl34NH3(紫色)分别与足量硝酸银溶液反应,都得到1molAgCl沉淀,则1molCoCl34NH3中有1molCl-为外界离子,钴的配位数为6,则配体为NH3和Cl-,两者空间构型不同导致颜色不同;
②由题意可知Co(OH)2在溶液中部分电离出[Co(OH)4]2和H+;
(3)由过渡元素A与 Co 属于同周期同族,基态原子排布中有四个未成对电子可知,A为Fe元素。
(1)在[Ni(NH3)6]2+中,Ni2+离子具有空轨道,NH3分子中N原子具有孤对电子,Ni2+与NH3之间能形成配位键,故答案为:配位键;N;
(2)①1molCOCl34NH3(绿色)和CoCl34NH3(紫色)分别与足量硝酸银溶液反应,都得到1molAgCl沉淀,则1molCoCl34NH3中有1molCl-为外界离子,钴的配位数为6,则配体为NH3和Cl-,所以其化学式都为 Co(NH3)4(Cl)2]Cl,因两者空间构型不同导致颜色不同,故答案为:6;空间结构不同;
②由题意可知Co(OH)2在溶液中部分电离出[Co(OH)4]2和H+,电离方程式为Co(OH)2+2H2O![]() [Co(OH)4]2+2H+,故答案为:Co(OH)2+2H2O
[Co(OH)4]2+2H+,故答案为:Co(OH)2+2H2O![]() [Co(OH)4]2+2H+;
[Co(OH)4]2+2H+;
(3)由过渡元素A与 Co 属于同周期同族,基态原子排布中有四个未成对电子可知,A为Fe元素。
①晶体与非晶体最本质的区别是组成物质的粒子在微观空间是否有序排列,x射线衍射可以看到微观结构,故区别X为晶体或非晶体的方法为X-射线衍射,故答案为:X-射线衍射;
②Fe(CO) 5常压下熔、沸点低,属于分子晶体,故答案为:分子晶体;
③A3+与SCN以1:4 的个数比配合形成[Fe(SCN)4]—离子,则FeCl3与KSCN在水溶液中发生反应的化学方程式FeCl3+4KSCN=K[Fe(SCN)4]+3KCl,故答案为:FeCl3+4KSCN=K[Fe(SCN)4]+3KCl;
④由B、C的外围电子排布分别为3d104s1、3s23p4可知B为Cu元素、C为S元素,由晶胞结构可知Fe原子有6个位于面上、4个位于棱上,个数为6×![]() +4×
+4×![]() =4,Cu原子有4个位于面上、1个位于体内、8个位于顶点,个数为,4×
=4,Cu原子有4个位于面上、1个位于体内、8个位于顶点,个数为,4×![]() +1+8×
+1+8×![]() =4,S原子数为8,晶体中N(Cu)∶N(Fe)∶N(S)=4∶4∶8=1∶1∶2,故该晶体的化学式为CuFeS2。晶胞质量为
=4,S原子数为8,晶体中N(Cu)∶N(Fe)∶N(S)=4∶4∶8=1∶1∶2,故该晶体的化学式为CuFeS2。晶胞质量为![]() ,晶胞体积为(524×10
,晶胞体积为(524×10![]() ≈4.32g/cm3,故答案为:CuFeS2;4.32。
≈4.32g/cm3,故答案为:CuFeS2;4.32。