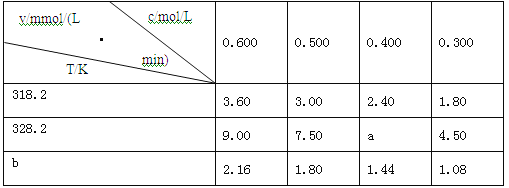
题目内容
【题目】(1)对于下列反应:2SO2 +O2![]() 2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用O2浓度变化来表示的反应速率为________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么用O2浓度变化来表示的反应速率为________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______。

(2)下图左表示在密闭容器中反应:2SO2+O2![]() 2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是_____;b-c过程中改变的条件可能是________;若增大压强时,反应速度变化情况画在c~d处。_______
2SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a-b过程中改变的条件可能是_____;b-c过程中改变的条件可能是________;若增大压强时,反应速度变化情况画在c~d处。_______
(3)酶是蛋白质,具有蛋白质的特性,酶能催化很多化学反应,下图表示酶参加的反应中,温度与反应速率的关系。解释曲线变化原因 __________________。

【答案】1mol/(L·min) 2 升温 减少SO3的浓度 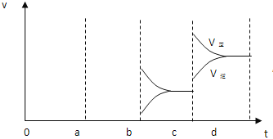 OA酶起催化作用,A点后T升高使酶失去生理活性
OA酶起催化作用,A点后T升高使酶失去生理活性
【解析】
(1)根据v=![]() 计算化学反应速率,根据同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比计算二氧化硫的反应速率,速率之比等于化学方程式计量数之比,根据反应速率计算二氧化硫反应量,从而得出2min时SO2的浓度;
计算化学反应速率,根据同一化学反应中同一时间段内各物质的反应速率之比等于其计量数之比计算二氧化硫的反应速率,速率之比等于化学方程式计量数之比,根据反应速率计算二氧化硫反应量,从而得出2min时SO2的浓度;
(2)正逆反应速率的变化结合温度、浓度对反应速率和化学平衡的影响判断;增大压强时,正逆反应速率均加快,平衡右移,据此分析;
(3)根据酶作催化剂时,有一个最适宜温度,低于此温度,酶的催化效果不明显,高于此温度,酶易变性分析。
(1)对于下列反应:2SO2+O22SO3△H<0,如果2min内SO2的浓度由6mol/L下降为2 mol/L,用SO2浓度变化来表示的化学反应速率为v=![]() =
=![]() =2mol/(Lmin),用O2浓度变化来表示的反应速率:v(O2)=
=2mol/(Lmin),用O2浓度变化来表示的反应速率:v(O2)=![]() ×2mol/(Lmin)=1mol/(Lmin);如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(Lmin),氧气消耗浓度=0.5mol/(Lmin)×2min=1mol/L,化学方程式定量计算得到消耗二氧化硫浓度为2mol/L,则二氧化硫的平衡浓度=4mol/L-2mol/L=2mol/L;
×2mol/(Lmin)=1mol/(Lmin);如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(Lmin),氧气消耗浓度=0.5mol/(Lmin)×2min=1mol/L,化学方程式定量计算得到消耗二氧化硫浓度为2mol/L,则二氧化硫的平衡浓度=4mol/L-2mol/L=2mol/L;
(2)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果,b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因;若增大压强时,平衡向正反应方向移动,则正逆反应速率都增大,且正反应速率大于逆反应速率,图象应为: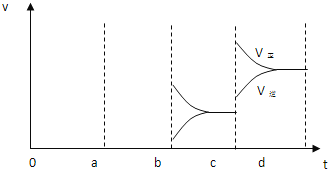 ;
;
(3)酶作催化剂时,有一个最适宜温度,低于此温度,酶的催化效果不明显,高于此温度,酶易变性,失去催化活性。

【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务,回答有关问题:
(1)在一定条件下,2H2O==2H2↑+O2↑,下图能正确表示该反应中能量变化的是________(用A、B表示)。

从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:则生成1mol水热量变化为________kJ。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
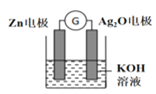
(2)在生产和生活中经常遇到化学能与电能的相互转化,银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意如图所示。在装置中Ag2O作_______极(填正或负)溶液中的K+向_____电极移动(填“Zn”或“Ag2O”);Ag2O电极发生______(还原或氧化反应),电极反应式为_____________________。
(3)一定温度下,将3molA气体和1molB气体通入一容积固定为1L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为_________;此时反应物B的转化率为_________。若反应经2min达到平衡,平衡时C的浓度_____0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为_________;此时反应物B的转化率为_________。若反应经2min达到平衡,平衡时C的浓度_____0.8mol/L(填“大于,小于或等于”)。