题目内容
【题目】实验室用下图所示装置进行液体石蜡分解及其产物性质实验。下列操作或叙述错误的是
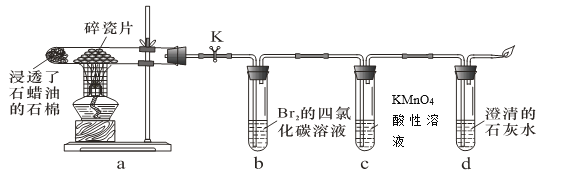
A.装置b、c中发生反应的基本类型不同B.d中溶液变浑浊证明石蜡分解产生了CO2
C.实验中可以看到b、c中溶液褪色D.停止加热后立即关闭K可以防止液体倒吸
【答案】B
【解析】
A.石蜡发生催化裂化分解可以得到烯烃,烯烃与Br2发生加成反应,烯烃与KMnO4发生氧化还原反应,反应类型不同,A正确,不选;
B.烯烃被高锰酸钾氧化,可能得到CO2,而不是石蜡分解产生了CO2,B错误,符合题意;
C.石蜡分解得到烯烃,烯烃与Br2发生加成反应,使Br2的CCl4溶液褪色;烯烃能被高锰酸钾氧化,而使高锰酸钾溶液褪色,C正确,不选;
D.停止加热后,如果不关闭K,装置中的气体压强由于温度降低而降低,会发生倒吸,如果及时关闭活塞K,可以防止倒吸,D正确,不选;
答案选B。

【题目】在2 L的密闭容器内,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=___________________________。已知:K300℃>K350℃,则该反应是______热反应。
(2)下图表示NO2变化的曲线是____。用O2表示从0~2 s内该反应的平均速率v=_________。

(3)能说明该反应已达到平衡状态的是________。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是________。
a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效催化剂
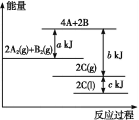
【题目】能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务,回答有关问题:
(1)在一定条件下,2H2O==2H2↑+O2↑,下图能正确表示该反应中能量变化的是________(用A、B表示)。

从断键和成键的角度分析上述反应中能量的变化。化学键的键能如下表:则生成1mol水热量变化为________kJ。
化学键 | H—H | O=O | H—O |
键能kJ/mol | 436 | 496 | 463 |
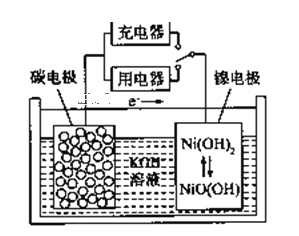
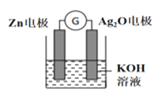
(2)在生产和生活中经常遇到化学能与电能的相互转化,银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意如图所示。在装置中Ag2O作_______极(填正或负)溶液中的K+向_____电极移动(填“Zn”或“Ag2O”);Ag2O电极发生______(还原或氧化反应),电极反应式为_____________________。
(3)一定温度下,将3molA气体和1molB气体通入一容积固定为1L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为_________;此时反应物B的转化率为_________。若反应经2min达到平衡,平衡时C的浓度_____0.8mol/L(填“大于,小于或等于”)。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,则1min内,B的平均反应速率为_______;x为_________;此时反应物B的转化率为_________。若反应经2min达到平衡,平衡时C的浓度_____0.8mol/L(填“大于,小于或等于”)。