题目内容
锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。
I.ZnSO4溶液的制备与提纯:
有关资料:a.菱锌矿的主要成分是ZnCO3,含少量SiO2、FeCO3、Cu2(OH)2CO3等;b.Zn(OH)2与Al(OH)3相似,能溶于过量的NaOH溶液生成Na2ZnO2;
(1)滤渣1的化学式为 ;②中使用的氧化剂最好是下列的 (填序号)。
| A.Cl2 | B.H2O2 | C.KMnO4 | D.浓HNO3 |
(3)步骤④发生的离子反应方程式为 。
II.BaS溶液的制备

有关数据:Ba(s)+S(s)+2O2(g)=BaSO4(s) △H1 = -1473.2 kJ?mol-1
C(s)+ 1/2O2(g)=CO(g) △H2 = -110.5 kJ?mol-1
Ba(s)+ S(s)=BaS(s) △H3 = -460 kJ?mol-1
(4)若煅烧还原的产物仅为BaS和CO,则其反应的热化学方程式为:
。
Ⅲ.制取锌钡白
(5)如果Ⅰ中步骤⑤使用硫酸过量,产生的后果是 。
(共16分)
(1)(4分)SiO2(2分) B(2分)
(2)(3分)Fe(OH)3、Cu(OH)2(2分) ①(1分)
(3)(4分)OH-+CO2= HCO3-(2分)、ZnO22-+ 2CO2 + 2H2O = Zn(OH)2↓ + 2HCO3-(2分)
(4)(3分)BaSO4(s) + 4C(s) =" BaS(s)" + 4CO(g) △H =" +571.2" kJ?mol-1
(5)(2分)过量的酸与BaS溶液混合会产生有毒的H2S气体污染空气(1分),而且锌钡白的产率会降低(1分)
解析试题分析:(1)ZnCO3、FeCO3、Cu2(OH)2CO3都能溶于足量5mol/LH2SO4溶液,符合复分解反应发生的条件,生成ZnSO4、FeSO4、CuSO4、CO2气体、H2O,而SiO2则不溶于硫酸,则步骤①酸浸之后所得滤渣1的化学式为SiO2,滤液1的主要成分是ZnSO4、FeSO4、CuSO4、H2O;步骤②中用Cl2能氧化Fe2+,但会引入新的杂质(Clˉ、Cl2),且过量的氯气有毒,故A错误;H2O2能氧化Fe2+,还原产物是H2O,不会引入新杂质,且过量H2O2受热易分解为水和氧气,故B正确;KMnO4能氧化Fe2+,但是会引入新的杂质(K+、Mn2+、KMnO4),故C错误;浓HNO3能氧化Fe2+,还原产物是有毒的NO2,且能引入新的杂质(NO3ˉ、HNO3),故D错误;(2)步骤②氧化后所得溶液的主要成分是ZnSO4、Fe2(SO4)3、CuSO4,都能与过量NaOH溶液反应,根据题意可知滤液2的主要成分是Na2ZnO2、NaOH,滤渣2的主要成分是Fe(OH)3、Cu(OH)2;步骤④中的CO2气体来自步骤①酸浸反应放出的气体,可以节能减排;(3)偏铝酸钠溶液通入过量CO2气体可以制氢氧化铝沉淀,由此推断步骤④发生的反应为Na2ZnO2、NaOH溶液分别与CO2气体的反应,NaOH+CO2=NaHCO3,Na2ZnO2+2H2O+2CO2=Zn(OH)2↓+2NaHCO3,则滤渣3为Zn(OH)2,滤液3的主要成分为NaHCO3;(4)根据盖斯定律,由②×4+③-①可以约去Ba(s)、S(s)、2O2(g),得到的热化学方程式为:BaSO4(s) + 4C(s) =" BaS(s)" + 4CO(g) △H =" +571.2" kJ?mol-1;(5)若步骤⑤为Zn(OH)2与过量硫酸的中和反应,所得溶液的主要成分为ZnSO4、H2SO4,ZnSO4、H2SO4溶液与BaS(s)混合时不仅可以制取锌钡白,而且过量的H2SO4与易与BaS(s)发生复分解反应,生成有毒的H2S气体,既导致空气污染,又减少锌钡白的产量。
考点:考查物质制备型工艺流程题,涉及关键环节所得成分分析、除杂试剂的选择、推断循环利用的物质、离子方程式的书写、热化学方程式的书写、实验方案的评价等热点。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
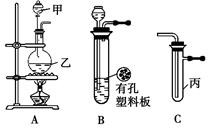
小学生10分钟应用题系列答案Inorganic Syntheses一书中,有一如下图所示的装置,用以制备某种干燥的纯净气体。该装置中所装的药品正确的是( )
| A.A中装浓硫酸,B中装浓盐酸 |
| B.A中装浓盐酸,B中装浓硫酸 |
| C.A中装氢氧化钠浓溶液,B中装浓氨水 |
| D.A中装浓氨水,B中装氢氧化钠浓溶液 |
下列各组气体在常温下能共存且能用向上排空气法收集的是
| A.NO和O2 | B.HCl和NH3 | C.H2和CO | D.SO2和CO2 |
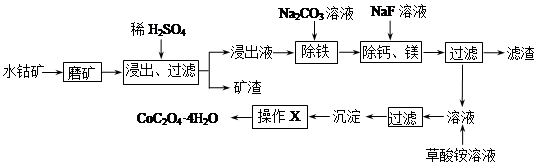

 。
。 CoO2+LiC6,写出该电池放电时的正极反应式 。
CoO2+LiC6,写出该电池放电时的正极反应式 。



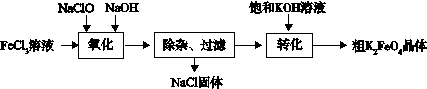
 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH