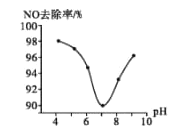
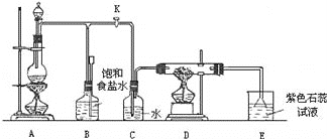
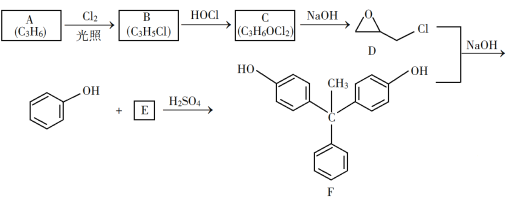
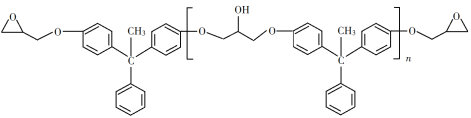
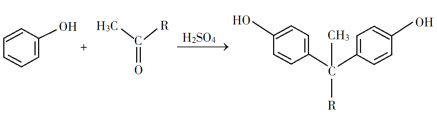
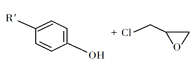
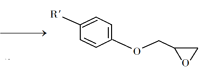
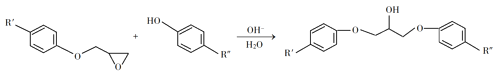
题目内容
【题目】将5.60 g纯铁粉加入适量稀硫酸中,固体完全溶解。加热条件下向反应液中先加入1.7 g NaNO3固体(已知NO3-在酸性条件下具有强氧化性),再通入448 mL Cl2(标准状况下,假设Cl2不逸出),产物中铁元素全部以Fe3+存在。(要求简要写出计算过程)
(1)被氯气氧化的Fe2+物质的量为________。
(2)NaNO3对应的还原产物中氮元素的化合价是________。
【答案】加热条件下,通入448 mL Cl2,Cl2不逸出,则Cl2全部参与反应2Fe2++Cl2=2Fe3++2Cl-,n(Fe2+)=2n(Cl2)=2×0.0200mol=0.0400mol NaNO3也是氧化剂,产物中铁元素全部以Fe3+存在,说明剩余的0.0600 mol Fe2+被NaNO3氧化,设NaNO3对应的还原产物中氮元素的化合价是+x,1.7 g NaNO3固体物资的量为![]() ,根据Fe2+~Fe3+~e-,NO
,根据Fe2+~Fe3+~e-,NO![]() ~Nx+~(5-x)e-可知,得失电子守恒:0.02×(5-x)=0.06,解得x=2
~Nx+~(5-x)e-可知,得失电子守恒:0.02×(5-x)=0.06,解得x=2
【解析】
(1)加热条件下,通入448 mL Cl2,Cl2不逸出,则Cl2全部参与反应2Fe2++Cl2=2Fe3++2Cl-,则n(Fe2+)=2n(Cl2);
(2)NaNO3也是氧化剂,产物中铁元素全部以Fe3+存在,说明剩余的Fe2+被NaNO3氧化,设NaNO3对应的还原产物中氮元素的化合价是+x,计算1.7 g NaNO3固体物资的量,再根据得失电子守恒计算NaNO3对应的还原产物中氮元素的化合价。
(1)加热条件下,通入448 mL Cl2,Cl2不逸出,则Cl2全部参与反应2Fe2++Cl2=2Fe3++2Cl-,n(Fe2+)=2n(Cl2)=2×0.0200mol=0.0400mol(三位有效数字);
故答案为:加热条件下,通入448 mL Cl2,Cl2不逸出,则Cl2全部参与反应2Fe2++Cl2=2Fe3++2Cl-,n(Fe2+)=2n(Cl2)=2×0.0200mol=0.0400mol;
(2)NaNO3也是氧化剂,产物中铁元素全部以Fe3+存在,说明剩余的0.0600 mol Fe2+被NaNO3氧化,设NaNO3对应的还原产物中氮元素的化合价是+x,1.7 g NaNO3固体物资的量为![]() ,根据Fe2+~Fe3+~e-,NO
,根据Fe2+~Fe3+~e-,NO![]() ~Nx+~(5-x)e-可知,得失电子守恒:0.02×(5-x)=0.06,解得x=2。
~Nx+~(5-x)e-可知,得失电子守恒:0.02×(5-x)=0.06,解得x=2。