题目内容
A、B、C、D、E、F、G、H、I、J分别代表十种不同的有机物(其中A是化学工业重要原料之一).它们之间的相互转化关系如图: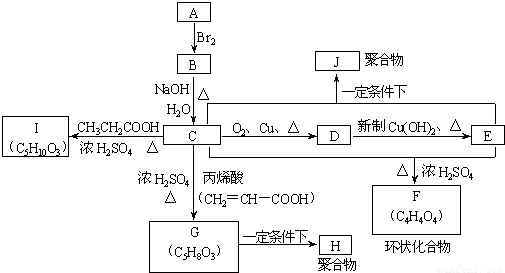
请回答下列问题:
(1)A的结构式简为______;F的结构简式为______;指G→H的反应类型______.
(2)写出下列转化的化学方程式.
①C→I______
【答案】分析:C能与羧酸反应、能在Cu加热条件下与氧气反应,C含有羟基-OH,由C、D、E转化可知,三者含有相同碳原子数目,C、E生成F,F的分子式为C4H4O4,故C中含有2个C原子,由A、B、C的转化可知,A中含有2个C原子,A是化学工业重要原料之一,能与溴反应,故A为CH2=CH2,B为BrCH2CH2Br,C为HOCH2CH2OH,D为OHC-CHO,E为HOOC-COOH,F为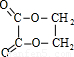 ,乙二醇与丙烯酸发生酯化反应生成G,结构G的分子式可知,G为CH2=CHCOOCH2CH2OH,乙二醇与CH3CH2COOH发生酯化反应生成I,根据I的分子式可知,I为CH3CH2COOCH2CH2OH,据此解答.
,乙二醇与丙烯酸发生酯化反应生成G,结构G的分子式可知,G为CH2=CHCOOCH2CH2OH,乙二醇与CH3CH2COOH发生酯化反应生成I,根据I的分子式可知,I为CH3CH2COOCH2CH2OH,据此解答.
解答:解:C能与羧酸反应、能在Cu加热条件下与氧气反应,C含有羟基-OH,由C、D、E转化可知,三者含有相同碳原子数目,C、E生成F,F的分子式为C4H4O4,故C中含有2个C原子,由A、B、C的转化可知,A中含有2个C原子,A是化学工业重要原料之一,能与溴反应,故A为CH2=CH2,B为BrCH2CH2Br,C为HOCH2CH2OH,D为OHC-CHO,E为HOOC-COOH,F为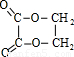 ,乙二醇与丙烯酸发生酯化反应生成G,结构G的分子式可知,G为CH2=CHCOOCH2CH2OH,乙二醇与CH3CH2COOH发生酯化反应生成I,根据I的分子式可知,I为CH3CH2COOCH2CH2OH,
,乙二醇与丙烯酸发生酯化反应生成G,结构G的分子式可知,G为CH2=CHCOOCH2CH2OH,乙二醇与CH3CH2COOH发生酯化反应生成I,根据I的分子式可知,I为CH3CH2COOCH2CH2OH,
(1)通过以上分析知,A的结构简式为:CH2=CH2,F为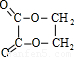 ,
,
G为CH2=CHCOOCH2CH2OH,在一定条件下发生加聚反应生成高聚物H,
故答案为:CH2=CH2,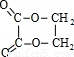 ,加聚反应;
,加聚反应;
(2)①C→I是乙二醇与CH3CH2COOH发生酯化反应生CH3CH2COOCH2CH2OH,反应方程式为:
CH3CH2COOH+HOCH2CH2OH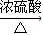 CH3CH2COOCH2CH2OH+H2O,
CH3CH2COOCH2CH2OH+H2O,
②C+E→J是乙二酸与乙二醇发生酯化反应反应生成高聚物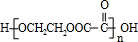 ,反应方程式为:
,反应方程式为:
nCH2OHCH2CH2OH+nHOOCCOOH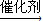
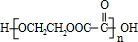 +(2n-1)H2O,
+(2n-1)H2O,
故答案为:CH3CH2COOH+HOCH2CH2OH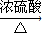 CH3CH2COOCH2CH2OH+H2O,
CH3CH2COOCH2CH2OH+H2O,
nCH2OHCH2CH2OH+nHOOCCOOH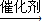
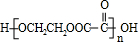 +(2n-1)H2O;
+(2n-1)H2O;
(3)CH2=CHCOOCH2CH2OH有多种同分异构体,其中能与NaOH溶液及硫酸溶液均可反应,分子中含有酯基-COO-,能发生银镜反应且生成的银与相应有机物的物质的量比为4:1,故含有1个醛基-CHO,且是甲酸形成的酯,符合条件的同分异构体有:HCOOCH2CH2CH2CHO、HCOOCH2CH(CH3)CHO、HCOOCH(CH3)CH2CHO、HCOOC(CH3)2CHO、HCOOCH(CH2CH3)CHO,故符合条件的同分异构体数目有5种,
故答案为:5,HCOOCH2CH2CH2CHO等.
点评:以框图题形式考查有机物的推断,根据反应中碳原子数目关系确定物质C含有2个碳原子是推断的关键,再结合反应的条件及产物的分子式进行推断,注意(3)中确定符合反应特征的官能团,进行书写同分异构体,难度中等.
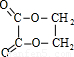 ,乙二醇与丙烯酸发生酯化反应生成G,结构G的分子式可知,G为CH2=CHCOOCH2CH2OH,乙二醇与CH3CH2COOH发生酯化反应生成I,根据I的分子式可知,I为CH3CH2COOCH2CH2OH,据此解答.
,乙二醇与丙烯酸发生酯化反应生成G,结构G的分子式可知,G为CH2=CHCOOCH2CH2OH,乙二醇与CH3CH2COOH发生酯化反应生成I,根据I的分子式可知,I为CH3CH2COOCH2CH2OH,据此解答.解答:解:C能与羧酸反应、能在Cu加热条件下与氧气反应,C含有羟基-OH,由C、D、E转化可知,三者含有相同碳原子数目,C、E生成F,F的分子式为C4H4O4,故C中含有2个C原子,由A、B、C的转化可知,A中含有2个C原子,A是化学工业重要原料之一,能与溴反应,故A为CH2=CH2,B为BrCH2CH2Br,C为HOCH2CH2OH,D为OHC-CHO,E为HOOC-COOH,F为
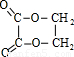 ,乙二醇与丙烯酸发生酯化反应生成G,结构G的分子式可知,G为CH2=CHCOOCH2CH2OH,乙二醇与CH3CH2COOH发生酯化反应生成I,根据I的分子式可知,I为CH3CH2COOCH2CH2OH,
,乙二醇与丙烯酸发生酯化反应生成G,结构G的分子式可知,G为CH2=CHCOOCH2CH2OH,乙二醇与CH3CH2COOH发生酯化反应生成I,根据I的分子式可知,I为CH3CH2COOCH2CH2OH,(1)通过以上分析知,A的结构简式为:CH2=CH2,F为
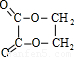 ,
,G为CH2=CHCOOCH2CH2OH,在一定条件下发生加聚反应生成高聚物H,
故答案为:CH2=CH2,
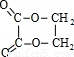 ,加聚反应;
,加聚反应;(2)①C→I是乙二醇与CH3CH2COOH发生酯化反应生CH3CH2COOCH2CH2OH,反应方程式为:
CH3CH2COOH+HOCH2CH2OH
 CH3CH2COOCH2CH2OH+H2O,
CH3CH2COOCH2CH2OH+H2O,②C+E→J是乙二酸与乙二醇发生酯化反应反应生成高聚物
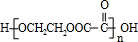 ,反应方程式为:
,反应方程式为:nCH2OHCH2CH2OH+nHOOCCOOH
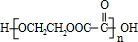 +(2n-1)H2O,
+(2n-1)H2O,故答案为:CH3CH2COOH+HOCH2CH2OH
 CH3CH2COOCH2CH2OH+H2O,
CH3CH2COOCH2CH2OH+H2O,nCH2OHCH2CH2OH+nHOOCCOOH
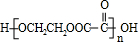 +(2n-1)H2O;
+(2n-1)H2O;(3)CH2=CHCOOCH2CH2OH有多种同分异构体,其中能与NaOH溶液及硫酸溶液均可反应,分子中含有酯基-COO-,能发生银镜反应且生成的银与相应有机物的物质的量比为4:1,故含有1个醛基-CHO,且是甲酸形成的酯,符合条件的同分异构体有:HCOOCH2CH2CH2CHO、HCOOCH2CH(CH3)CHO、HCOOCH(CH3)CH2CHO、HCOOC(CH3)2CHO、HCOOCH(CH2CH3)CHO,故符合条件的同分异构体数目有5种,
故答案为:5,HCOOCH2CH2CH2CHO等.
点评:以框图题形式考查有机物的推断,根据反应中碳原子数目关系确定物质C含有2个碳原子是推断的关键,再结合反应的条件及产物的分子式进行推断,注意(3)中确定符合反应特征的官能团,进行书写同分异构体,难度中等.

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.