题目内容
【题目】I.某学生利用左图装置测定反应过程中所放出的热量并计算中和热。请回答问题:
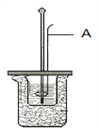
图中A仪器名称为__________。烧杯间填满碎纸条的作用是____________。
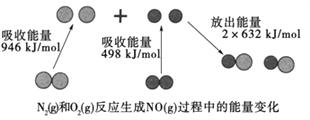
Ⅱ.右图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化示意图,
试判断1mol N2(g)和1mol O2(g)具有的总能量__________2mol NO(g)具有的总能量。(“大于”或“小于”)
Ⅲ.有如下两个反应:A、2HCl+Ba(OH)2= BaCl2+2H2O;B、2Fe3++Cu= 2Fe2++Cu2+
(1)根据两反应的本质,判断能设计成原电池的是:__________(填“A”或“B” )。
(2)根据能设计成原电池的反应选择适合的材料和试剂设计一个原电池:
①负极材料是_________,电解质溶液是__________;
②写出负极的电极反应式______________;
③原电池工作时溶液中的Cl-向_________极移动(填”正”或”负”)。
【答案】 环形玻璃搅拌棒 减少实验过程中的热量损失 小于 B Cu FeCl3 溶液 Cu-2e- =Cu2+ 负
【解析】试题分析:I.图中A仪器是环形玻璃搅拌棒 。碎纸条能隔热。
Ⅱ.反应物的总键能-生成物的总键能=焓变,根据焓变判断反应物、生成物能量的大小;
Ⅲ.有如下两个反应:A、2HCl+Ba(OH)2= BaCl2+2H2O;B、2Fe3++Cu= 2Fe2++Cu2+
(1)氧化还原反应能设计成原电池。
(2)原电池中负极发生氧化反应,电解质发生还原反应;电解池中阴离子移向负极。
解析:I. 量热器A仪器是环形玻璃搅拌棒 。碎纸条能隔热,烧杯间填满碎纸条的作用是减少实验过程中的热量损失;Ⅱ.N2(g)+O2(g)=2NO(g),△H=946+498-632×2=180KJ/mol,反应放热,1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量;
Ⅲ.有如下两个反应:A、2HCl+Ba(OH)2= BaCl2+2H2O;B、2Fe3++Cu= 2Fe2++Cu2+
(1)2Fe3++Cu= 2Fe2++Cu2+属于氧化还原反应,有电子转移,2Fe3++Cu= 2Fe2++Cu2+能设计成原电池。
(2)反应2Fe3++Cu= 2Fe2++Cu2+中,铜失电子发生氧化反应,Fe3+得电子发生还原反应,①负极材料是Cu,电解质溶液是FeCl3 溶液;②写出负极的电极反应式Cu-2e- =Cu2+;③电解池中阴离子移向负极,Cl-向负极移动。

【题目】某温度下,密闭容器中X、Y、Z、W四种气体的初始浓度和平衡浓度如表,下列说法错误的是( )
物质 | X | Y | Z | W |
初始浓度/molL﹣1 | 0.5 | 0.6 | 0 | 0 |
平衡浓度/molL﹣1 | 0.1 | 0.1 | 0.4 | 0.6 |
A. 反应达到平衡时,X的转化率为80%
B. 该反应的平衡常数表达式为k=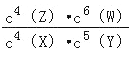
C. 增大压强其平衡常数不变,但使平衡向生成Z的方向移动
D. 改变温度可以改变此反应的平衡常数

