题目内容
【题目】X、Y和Z均为短周期主族元素,原子序数依次增大,X的单质为密度最小的气体,Y原子最外层电子数是其周期数的三倍,Z与X原子最外层电子数相同。回答下列问题:
(1)Y元素的名称为________。Z的离子结构示意图为_________。
元素Y的简单离子和元素Z的简单离子,半径较大的是________(写出离子符号)。
(2)X和Y组成的化合物中,既含极性共价键又含非极性共价键的是______(写化学式),该物质核外电子总数为______。
(3)化合物Z2Y2的电子式为___________。
(4)X的单质与Y的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极电极反应式为_________。
【答案】 氧 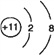 O2- H2O2 18
O2- H2O2 18 ![]() 2H2O +O2 +4e- =4OH-
2H2O +O2 +4e- =4OH-
【解析】试题分析: X的单质为密度最小的气体,X是H元素;Y原子最外层电子数是其周期数的三倍,Y是O元素;Z与X原子最外层电子数相同,Z是Na元素。
解析:根据以上分析,(1)Y元素的名称为氧。Z是Na元素,Na+结构示意图为![]() 。
。
O2-与Na+电子层数相同,O原子序数小于Na,所以O2-半径较大。
(2)H和O组成的化合物是H2O、H2O2,既含极性共价键又含非极性共价键的是H2O2, H2O2核外电子总数为18。
(3)化合物Na2O2的电子式为![]() ;
;
(4)氢氧燃料电池(KOH溶液作电解质溶液),负极通入氢气,正极通入氧气发生还原反应,正极电极反应式为2H2O +O2 +4e- =4OH-。

练习册系列答案
相关题目