题目内容
【题目】下列与实验相关的叙述错误的是( )
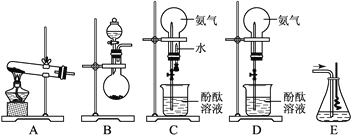
A.蒸馏时蒸馏烧瓶中液体的体积不能超过容积的![]() ,液体也不能蒸干
,液体也不能蒸干
B.给试管中的液体加热时要不时移动试管,以免暴沸
C.可用稀硝酸鉴别MgI2、AgNO3、Na2CO3、NaAlO2四种溶液
D.稀释浓硫酸时,如果戴有防护眼罩,可以把水慢慢倒入装有浓硫酸的烧杯中
【答案】D
【解析】选D。烧瓶中液体不能太多,也不能太少,则蒸馏时蒸馏烧瓶中液体的体积不能超过容积的![]() ,液体也不能蒸干,故A正确;加热试管,先预热后均匀受热,则加热时要不时移动试管,以免暴沸,故B正确;MgI2、AgNO3、Na2CO3、NaAlO2四种溶液分别与硝酸反应的现象为溶液为紫色、无现象、生成气体、先生成沉淀后溶解,现象不同,可鉴别,故C正确;稀释时,将密度大的液体注入密度小的液体中,并及时散热,则应把浓硫酸慢慢倒入装有水的烧杯中,并利用玻璃棒不断搅拌,故D错误。
,液体也不能蒸干,故A正确;加热试管,先预热后均匀受热,则加热时要不时移动试管,以免暴沸,故B正确;MgI2、AgNO3、Na2CO3、NaAlO2四种溶液分别与硝酸反应的现象为溶液为紫色、无现象、生成气体、先生成沉淀后溶解,现象不同,可鉴别,故C正确;稀释时,将密度大的液体注入密度小的液体中,并及时散热,则应把浓硫酸慢慢倒入装有水的烧杯中,并利用玻璃棒不断搅拌,故D错误。

【题目】(Ⅰ)沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。难溶物在水中溶解达到饱和时,即建立沉淀溶解平衡,平衡常数称为溶度积(Ksp)。已知25℃时,Ksp(BaSO4)=1×10-10,Ksp(BaCO3)=1×10-9。
(1)将浓度均为0.1mol/L的BaCl2溶液与Na2SO4溶液等体积混合,充分搅拌后过滤,滤液中c(Ba2+)=________mol/L。取100mL滤液与100mL2mol/LNa2SO4的溶液混合,混合液中c(Ba2+)= ______mol/L。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4 转化为CaCO3的离子方程式为___________________
②请分析CaSO4 转化为CaCO3的原理____________________
(Ⅱ)联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为_________________。
(2)①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
④2 N2H4(l) + N2O4(l)= 3N2(g)+ 4H2O(g) △H4=-1048.9kJ/mol
上述反应热效应之间的关系式为△H4=________________,联氨和N2O4可作为火箭推进剂的主要原因为________________________。
(Ⅲ)某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。

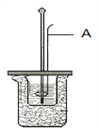
(1)滴定
①用 _____式滴定管盛装0.1000 mol/L盐酸标准液,锥形瓶中装有25.00mL待测烧碱溶液。上图表示某次滴定时50 mL滴定管中前后液面的位置。请将用去的标准盐酸的体积填入②表空格中。
②有关数据记录如下:
滴定序号 | 待测液体积(mL) | 所消耗盐酸标准液的体积(mL) | ||
滴定前 | 滴定后 | 消耗的体积 | ||
1 | 25.00 | 0.50 | 25.95 | 25.45 |
2 | 25.00 | _______ | _______ | ______ |
3 | 25.00 | 6.00 | 31.55 | 25.55 |
(2)根据所给数据,计算出烧碱样品的物质的量浓度。c = _________________。
(3)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果 ________ ;
b.读数时,若滴定前仰视,滴定后俯视,则会使测定结果__________ ;