��Ŀ����
����Ŀ���赥�ʼ��仯����Ӧ�÷�Χ�ܹ㡣
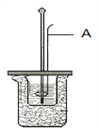
(1)�Ʊ���뵼����ϱ����ȵõ��ߴ��裬��ҵ�Ͽ������²����Ʊ��ߴ��衣
��.��������̼��ԭ���������Ƶôֹ裻
��.�ֹ�������������450��500 �������·�Ӧ�Ƶ�SiCl4��
��.SiCl4Һ�徭�����ᴿ�������H2��1 100��1 200 �������·�Ӧ�Ƶøߴ��衣
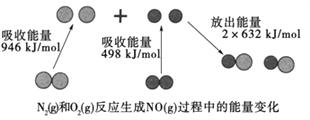
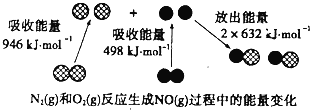
��֪SiCl4�е�Ϊ57.6 �棬����H2Oǿ�ҷ�Ӧ��
��ش��������⣺
�ٵڢ�Ӧ�Ļ�ѧ����ʽΪ____________________________________��
�������Ʊ�����Ĺ����б����ϸ��������ˮ�����������¡�SiCl4�ڳ�ʪ�Ŀ�������ˮ���������ɫ����������������_______��H2��ԭSiCl4������������O2����������ĺ����________________________________________��
(2)�������豻��������������������ҵ����SiO2��Na2CO3��CaCO3��283 kg�ڸ�������ȫ��Ӧʱ�ų�CO2 44 kg���������IJ������û�ѧʽNa2SiO3��CaSiO3��xSiO2��ʾ��������x��________��
���𰸡� 2H2��SiCl4![]() Si��4HCl H2SiO3(��H4SiO4)��HCl ��ը 4
Si��4HCl H2SiO3(��H4SiO4)��HCl ��ը 4
��������(1)��������1 100��1 200 ���������������Ȼ��跴Ӧ���ɵ��ʹ���Ȼ��⣬�仯ѧ��Ӧ����ʽΪ��2H2��SiCl4![]() Si��4HCl����SiCl4�ڳ�ʪ�Ŀ�������ˮ���������ɫ��������SiCl4��ˮ��Ӧ����H2SiO3����H4SiO4����HCl��H2��ԭSiCl4������������O2����������ը����2�������Ļ�ѧ��ɿɸ��ݷ�Ӧԭ���õ���
Si��4HCl����SiCl4�ڳ�ʪ�Ŀ�������ˮ���������ɫ��������SiCl4��ˮ��Ӧ����H2SiO3����H4SiO4����HCl��H2��ԭSiCl4������������O2����������ը����2�������Ļ�ѧ��ɿɸ��ݷ�Ӧԭ���õ���
Na2CO3+SiO2![]() NaSiO3+CO2����CaCO3+SiO2
NaSiO3+CO2����CaCO3+SiO2![]() CaSiO3+CO2�����ɻ�ѧʽNa2SiO3CaSiO3xSiO2��Ӧ��Na2CO3��CaCO3�����ʵ�����ȣ�n��CO2��=n��Na2CO3��+n��CaCO3��=n��SiO2��Ӧ��=
CaSiO3+CO2�����ɻ�ѧʽNa2SiO3CaSiO3xSiO2��Ӧ��Na2CO3��CaCO3�����ʵ�����ȣ�n��CO2��=n��Na2CO3��+n��CaCO3��=n��SiO2��Ӧ��=![]() =1000mol��n��Na2CO3��=n��CaCO3��=500mol��500molNa2CO3��������53kg��500molCaCO3��������50kg��1000molSiO2��������60kg��n��SiO2������=
=1000mol��n��Na2CO3��=n��CaCO3��=500mol��500molNa2CO3��������53kg��500molCaCO3��������50kg��1000molSiO2��������60kg��n��SiO2������=![]() =2000mol����ʣ��Ķ�����������ɵĹ���ơ�������Ϊ2000��500��500=4��1��1������x=4����Ϊ��4��
=2000mol����ʣ��Ķ�����������ɵĹ���ơ�������Ϊ2000��500��500=4��1��1������x=4����Ϊ��4��

 ��У���˿��ֿ���ϵ�д�
��У���˿��ֿ���ϵ�д�