题目内容
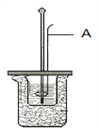
【题目】某化学兴趣小组以黄铜矿(主要成分CuFeS2)为原料进行如下实验探究,为测定黄铜矿中硫元素的质量分数,将m1g该黄铜矿样品放入如图所示装置中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铜矿样品。

(1)锥形瓶A内所盛试剂是________溶液;装置B的作用是________________;
锥形瓶D内发生反应的离子方程式为__________________________________。
(2)反应结束后将锥形瓶D中的溶液进行如下处理:

如图则向锥形瓶D中加入过量H2O2溶液反应的离子方程式为________________;
操作Ⅱ是洗涤、烘干、称重,其中洗涤的具体方法_________________________;
该黄铜矿中硫元素的质量分数为________(用含m1、m2的代数式表示)。
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是________。
A.KSCN溶液、氯水
B.稀盐酸、KMnO4溶液
C.稀硫酸、KMnO4溶液
D.NaOH溶液
(4)已知:Cu+在强酸性环境中会发生反应生成Cu和Cu2+,设计实验方案验证泡铜中是否含有Cu2O?
______________________。
【答案】(1)氢氧化钠 干燥气体 SO2+2OH-S![]() +H2O
+H2O
(2)H2O2+S![]() S
S![]() +H2O 固体放入过滤器中,用玻璃棒引流向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复上述操作2~3次
+H2O 固体放入过滤器中,用玻璃棒引流向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复上述操作2~3次
![]() ×100%
×100%
(3)C
(4)取少量泡铜于试管中加入适量稀硫酸,若溶液呈蓝色说明泡铜中含有Cu2O,否则不含有
【解析】(1)为防止二氧化碳的干扰,应将空气中的二氧化碳用碱液除掉,锥形瓶A内所盛试剂是氢氧化钠溶液,通过碱石灰干燥吸收水蒸气,生成的二氧化硫能和过量氢氧化钠反应生成亚硫酸钠和水,反应的离子方程式为SO2+2OH-S![]() +H2O。
+H2O。
(2)亚硫酸根离子具有还原性能被过氧化氢氧化生成硫酸根离子,反应的离子方程式为H2O2+S![]() S
S![]() +H2O,洗涤固体在过滤器中进行,加水至浸没固体使水自然流下,重复几次洗涤干净,具体操作为固体放入过滤器中,用玻璃棒引流向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复上述操作2~3次;m2g固体为硫酸钡的质量,结合硫元素守恒计算得到硫元素的质量分数=
+H2O,洗涤固体在过滤器中进行,加水至浸没固体使水自然流下,重复几次洗涤干净,具体操作为固体放入过滤器中,用玻璃棒引流向过滤器中加入蒸馏水至浸没沉淀,待水自然流下后,重复上述操作2~3次;m2g固体为硫酸钡的质量,结合硫元素守恒计算得到硫元素的质量分数=![]() ×100%=
×100%=![]() ×100%。
×100%。
(3)反应后固体经熔炼、煅烧后得到泡铜(Cu、Cu2O)和熔渣(Fe2O3、FeO),要验证熔渣中存在FeO,应选用的最佳试剂是加入硫酸溶解后加入高锰酸钾溶液,观察高锰酸钾溶液是否褪色设计检验方案。
(4)泡铜成分为Cu、Cu2O,Cu+在强酸性环境中会发生反应生成Cu和Cu2+,据此设计实验验证是否含有氧化亚铜,取少量泡铜于试管中加入适量稀硫酸,若溶液呈蓝色说明泡铜中含有Cu2O,否则不含有。