题目内容
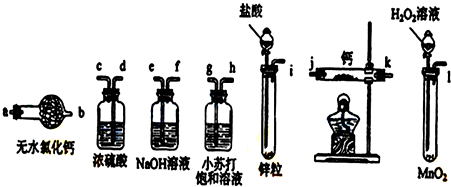
1.氧化二氯是黄棕色具有强烈刺激性的气体.它的熔点-116℃,沸点3.8℃.氧化二氯不稳定,接触一般有机物易爆炸;它易溶于水(1:100)同时反应生成次氯酸溶液.制取少量氧化二氯,是用干燥的氧化汞与氯气反应(还生成HgO•HgCl2).装置如图,仅铁架台和夹持仪器已略去.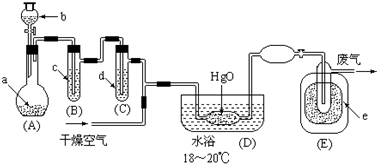
部分物质的有关物理数据如下:?
| 化学式 | 熔点(单位:℃) | 沸点(单位:℃) |
| N2 | -209.86 | -195.8 |
| O2 | -218.4 | -183 |
| CO2 | -57 | / |
| NH3 | -77.3 | -33.35 |
| Cl2 | -101 | -34.6 |
(1)A中深色固体与无色液体制备气体的离子方程式:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O.
(2)B中盛有液体c是饱和饱和NaCl溶液,C中的液体d是浓硫酸.?
(3)氧化二氯制备出之后,要冷却为固态才便于操作和贮存,则E中的保温瓶中盛有致冷剂,它应是液态空气 (在干冰、冰水、液态空气、液氨中选择).在E的内管得到的Cl2O中可能含有的主要杂质是反应物中过量的液氯.
(4)装置D、E间的连接方式与A、B、C间的连接方式有明显的区别,这区别是D、E中无橡胶管、塞,用这些不同的连接方式的主要理由是氧化二氯接触有机物而爆炸.
分析 由装置图可知,A中发生反应制备氯气,反应不需加热,深色固体试剂a与溶液b反应,应为高锰酸钾与浓盐酸,生成的氯气中含有氯化氢和水份杂质,B装置中用饱和食盐水除氯化氢,C装置中用浓硫酸干燥氯气,干燥的氯气与氧化汞反应生成二氧化氯,根据题中提供的各物质的沸点,E装置中用液态空气进行冷却得到液态氧化二氯,
(1)高锰酸钾与浓盐酸反应生成氯化锰、氯化钾、氯气、水,根据电荷守恒和元素守恒书写离子方程式;
(2)HCl易挥发,A中生成的氯气中含有HCl、H2O,用饱和食盐水吸收HCl,用浓硫酸干燥,先除氯化氢,后干燥;
(3)由题目信息可知,氧化二氯气体的熔点-116℃,熔点很低,只有液态氮气和氧气的沸点低于-116℃,干冰、液氨、冰水的冷却温度都高于-116℃左右;
(4)由信息可知,氧化二氯不稳定,接触一般有机物易爆炸,D、E间不能用乳胶管连接;
解答 解:由装置图可知,A中发生反应制备氯气,反应不需加热,深色固体试剂a与溶液b反应,应为高锰酸钾与浓盐酸,生成的氯气中含有氯化氢和水份杂质,B装置中用饱和食盐水除氯化氢,C装置中用浓硫酸干燥氯气,干燥的氯气与氧化汞反应生成二氧化氯,根据题中提供的各物质的沸点,E装置中用液态空气进行冷却得到液态氧化二氯,
(1)高锰酸钾与浓盐酸反应生成氯化锰、氯化钾、氯气、水,反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
(2)HCl易挥发,A中生成的氯气中含有HCl、H2O,用饱和食盐水吸收HCl,用浓硫酸干燥,先除氯化氢,后干燥,
故答案为:饱和NaCl溶液;
(3)由题目信息可知,氧化二氯气体的熔点-116℃,熔点很低,只有液态氮气和氧气的沸点低于-116℃,干冰、液氨、冰水的冷却温度都高于-116℃左右,所以要用液态空气冷却,根据工艺流程可知,D中反应氯气可能不能充分反应,且氯气易液化,所以E的内管得到的氧化二氯中可能含有杂质是液氯,
故答案为:液态空气;液氯;
(4)由信息可知,氧化二氯不稳定,接触一般有机物易爆炸,D、E间不能用乳胶管连接,
故答案为:橡胶; 爆炸.
点评 考查学生对实验原理及装置的理解、阅读题目获取信息的能力、以及充分利用所给信息设计合理的实验流程和实验条件控制能力等,关键是掌握整个制备流程原理,分析流程中各装置的作用.要求学生要有扎实的实验基础知识和灵活应用信息解决问题的能力.

实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| A | B | C | ||
| (1) | 1 | 3 | 0 | 放出热量a kJ |
| (2) | 0 | 0 | 2 | 吸收热量b kJ |
| (3) | 2 | 6 | 0 | 放出热量c kJ |
| A. | A的体积分数:(2)>(1)>(3) | |
| B. | 三个容器内反应的平衡常数:K(3)=K2(1)=K2(2) | |
| C. | 达平衡时体系压强:P(3)=2P(1) | |
| D. | 热量关系:a+b=50 |
| A. | 100mL | B. | 40mL | C. | 25mL | D. | 20mL |
| A. | NaCN水溶液显碱性:CN-+H2O?HCN+OH- | |
| B. | Mg(OH)2固体投人FeCl3溶液中:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3 | |
| C. | Na2S水解:S2-+2H20?H2S+2OH- | |
| D. | H2CO3在水溶液中电离:H2CO3?CO32-+2H+ |
FeSO4+Na2CO3═FeCO3↓+Na2SO4,FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.
①铁粉的作用是防止+2价的铁元素被氧化.
②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁.结合图中的绿矾溶解度曲线,完成由烧渣制备绿矾晶体的操作.
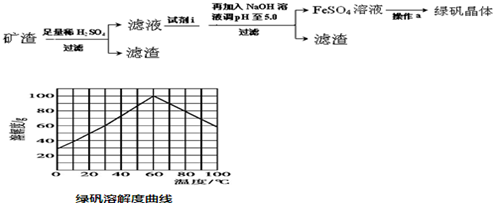
试剂i铁粉,加入试剂i反应的离子方程式为2Fe3++Fe=3Fe2+.操作a为加热到60℃浓缩、冷却结晶、过滤.
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g•cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |
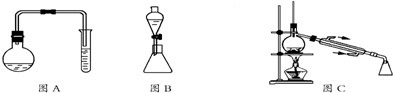
实验一:制取苯甲酸甲酯
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,试管中盛放的液体可能是Na2CO3溶液,烧瓶中反应的方程式为
 .
.实验二:提纯苯甲酸甲酯
(2)停止加热,待烧瓶内的混合物冷却后,将试管及烧瓶中的液体转移到分液漏斗中,然后塞上分液漏斗的塞子再振荡后静置,取下塞子、打开活塞,使(填主要成分的名称)苯甲酸甲酯进入锥形瓶,此时目标产物中所含杂质量最多的物质是甲醇.
(3)用图C装置进行蒸馏提纯时,当温度计显示199.6℃时,可用锥形瓶收集苯甲酸甲酯.
| A. | 钠跟水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 碳酸氢钠溶液跟盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| C. | 过量二氧化碳跟苛性钾反应:CO2+2OH-=CO32-+H2O | |
| D. | 硫酸氢钾和氢氧化钡按等物质的量在溶液中反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O |