题目内容
2.在标况下,一个装满Cl2的容器质量为74.6克;若装满N2则重为66克,那么此容器的容积为( )| A. | 22.4升 | B. | 44.8升 | C. | 11.2升 | D. | 4.48升 |
分析 相同条件下,气体摩尔体积相等,相同体积的不同气体其物质的量相等,设容器的质量为xg,则存在$\frac{74.6g-xg}{71g/mol}$=$\frac{66g-xg}{28g/mol}$,x=59.5g,则氯气质量=(74.6-59.5)g=15.1g,根据V=nVm计算容器体积.
解答 解:相同条件下,气体摩尔体积相等,相同体积的不同气体其物质的量相等,设容器的质量为xg,则存在$\frac{74.6g-xg}{71g/mol}$=$\frac{66g-xg}{28g/mol}$,x=59.5g,则氯气质量=(74.6-59.5)g=15.1g,容器体积V=nVm=$\frac{15.1g}{71g/mol}×22.4L/mol$=4.48L,故选D.
点评 本题考查物质的量有关计算,为高频考点,明确相同条件下不同气体体积之比等于其物质的量之比是解本题关键,题目难度不大.

练习册系列答案
相关题目
17.向盛有100mL 0.5mol•L-1的硫酸溶液中加入25mL 0.8mol•L-1的氯化钡溶液,过滤后,向滤液中滴加氢氧化钠溶液中和其酸性,需2.5mol•L-1的氢氧化钠溶液( )
| A. | 100mL | B. | 40mL | C. | 25mL | D. | 20mL |
13.柠檬酸亚铁(FeC6H6O7)是一种易吸收的高效铁制剂,可由绿矾(FeSO4•7H2O)通过下列反应制备:
FeSO4+Na2CO3═FeCO3↓+Na2SO4,FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
(1)制备FeCO3时,选用的加料方式是c(填字母).
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.
①铁粉的作用是防止+2价的铁元素被氧化.
②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁.结合图中的绿矾溶解度曲线,完成由烧渣制备绿矾晶体的操作.
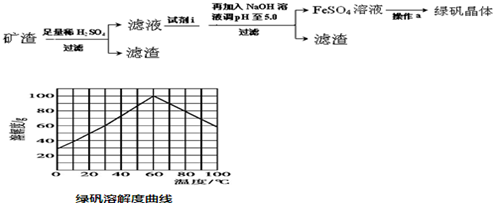
试剂i铁粉,加入试剂i反应的离子方程式为2Fe3++Fe=3Fe2+.操作a为加热到60℃浓缩、冷却结晶、过滤.
FeSO4+Na2CO3═FeCO3↓+Na2SO4,FeCO3+C6H8O7═FeC6H6O7+CO2↑+H2O
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0mol•L-1计算).
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |
a.将FeSO4溶液与Na2CO3溶液同时加入到反应容器中
b.将FeSO4溶液缓慢加入到盛有Na2CO3溶液的反应容器中
c.将Na2CO3溶液缓慢加入到盛有FeSO4溶液的反应容器中
(2)生成的FeCO3沉淀需经充分洗涤,检验洗涤是否完全的方法取最后一次的洗涤滤液1~2 mL 于试管中,向其中滴加用盐酸酸化的BaCl2溶液,若无白色沉淀产生,则表明已洗涤干净.
(3)将制得的FeCO3加入到足量柠檬酸溶液中,再加入少量铁粉,80℃下搅拌反应.
①铁粉的作用是防止+2价的铁元素被氧化.
②反应结束后,无需过滤,除去过量铁粉的方法是加入适量柠檬酸让铁粉反应完全.
(4)最后溶液经浓缩、加入适量无水乙醇、静置、过滤、洗涤、干燥,获得柠檬酸亚铁晶体.分离过程中加入无水乙醇的目的是降低柠檬酸亚铁在水中的溶解量,有利于晶体析出.
(5)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备绿矾,再合成柠檬酸亚铁.结合图中的绿矾溶解度曲线,完成由烧渣制备绿矾晶体的操作.

试剂i铁粉,加入试剂i反应的离子方程式为2Fe3++Fe=3Fe2+.操作a为加热到60℃浓缩、冷却结晶、过滤.
10.苯甲酸甲酯是一种重要的工业原料,某研究性学习小组的同学拟用如图所示装置(图A中的加热装置没有画出)制取高纯度的苯甲酸甲酯,实验前他们从有关化学手册中查得相关物质的物理性质如表所示:
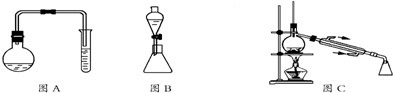
实验一:制取苯甲酸甲酯
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,试管中盛放的液体可能是Na2CO3溶液,烧瓶中反应的方程式为 .
.
实验二:提纯苯甲酸甲酯
(2)停止加热,待烧瓶内的混合物冷却后,将试管及烧瓶中的液体转移到分液漏斗中,然后塞上分液漏斗的塞子再振荡后静置,取下塞子、打开活塞,使(填主要成分的名称)苯甲酸甲酯进入锥形瓶,此时目标产物中所含杂质量最多的物质是甲醇.
(3)用图C装置进行蒸馏提纯时,当温度计显示199.6℃时,可用锥形瓶收集苯甲酸甲酯.
| 苯甲酸 | 甲醇 | 苯甲酸甲酯 | |
| 熔点/℃ | 122.4 | -97 | -12.3 |
| 沸点/℃ | 249 | 64.3 | 199.6 |
| 密度/g•cm-3 | 1.2659 | 0.792 | 1.0888 |
| 水溶性 | 微溶 | 互溶 | 不溶 |

实验一:制取苯甲酸甲酯
(1)在烧瓶中混合有机物及浓硫酸的方法是先将一定量的苯甲酸放入烧瓶中,然后再加入甲醇,最后边振荡边缓慢加入一定量的浓硫酸,试管中盛放的液体可能是Na2CO3溶液,烧瓶中反应的方程式为
 .
.实验二:提纯苯甲酸甲酯
(2)停止加热,待烧瓶内的混合物冷却后,将试管及烧瓶中的液体转移到分液漏斗中,然后塞上分液漏斗的塞子再振荡后静置,取下塞子、打开活塞,使(填主要成分的名称)苯甲酸甲酯进入锥形瓶,此时目标产物中所含杂质量最多的物质是甲醇.
(3)用图C装置进行蒸馏提纯时,当温度计显示199.6℃时,可用锥形瓶收集苯甲酸甲酯.
7.下列物质分类正确的是( )
| A. | 稀豆浆、雾、淀粉溶液、硫酸铜溶液均为胶体,也为混合物 | |
| B. | SO2、H2O、CO、CO2均为酸性氧化物,也为非金属氧化物 | |
| C. | 干冰、氨气、冰水混合物均为纯净物,也为化合物 | |
| D. | 凡是溶于水后能电离出H+的化合物就叫酸 |
14.不能用离子方程式2H++CO32-=H2O+CO2↑表示的化学方程式是( )
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | Na2CO3+2HCl═2NaCl+H2O+CO2↑ | ||
| C. | K2CO3+2HCl═2KCl+H2O+CO2↑ | D. | Na2CO3+2HNO3═2NaNO3+H2O+CO2↑ |
11.下列离子方程式的书写中,正确的是( )
| A. | 钠跟水反应:Na+2H2O=Na++2OH-+H2↑ | |
| B. | 碳酸氢钠溶液跟盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| C. | 过量二氧化碳跟苛性钾反应:CO2+2OH-=CO32-+H2O | |
| D. | 硫酸氢钾和氢氧化钡按等物质的量在溶液中反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
