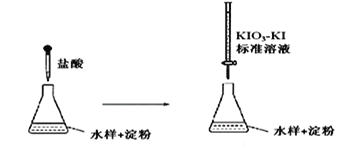
题目内容
【题目】将一定量的铜粉加入到0.5 L 0.3 mol·L-1 Fe2(SO4)3和0.1 mol·L-1 H2SO4的混合溶液中,铜粉完全溶解后,得到溶液X。下列说法正确的是 ( )
A. 溶液X中Cu2+与Fe2+的物质的量之比为2∶1
B. 向溶液X中加入足量铁粉,充分反应后,铁粉质量减少11.2 g
C. 向溶液X中滴加KSCN溶液,未变红色,则加入铜粉质量为12.8 g
D. 向溶液X中加入0.18 L 5 mol·L-1 NaOH溶液可使溶液中的金属离子完全沉淀
【答案】B
【解析】A、加入铜粉时只发生反应Cu+2Fe3+=Cu2++2Fe2+,根据反应可知,溶液X中Cu2+与Fe2+的物质的量之比为1∶2,选项A错误;B、根据氧化还原反应原理可知,消耗铁粉的量只可以直接按原溶液中铁离子和氢离子计算2Fe3++Fe=3Fe2+、2H++Fe=Fe2++H2↑,则铁粉质量减少(0.5 L![]() 0.3 mol·L-1 +0.5 L
0.3 mol·L-1 +0.5 L![]() 0.1 mol·L-1)
0.1 mol·L-1)![]() =11.2g,选项B正确;C、向溶液X中滴加KSCN溶液,未变红色,则Fe3+刚好反应完,根据反应Cu+2Fe3+=Cu2++2Fe2+可知,加入铜粉质量为0.5 L
=11.2g,选项B正确;C、向溶液X中滴加KSCN溶液,未变红色,则Fe3+刚好反应完,根据反应Cu+2Fe3+=Cu2++2Fe2+可知,加入铜粉质量为0.5 L![]() 0.3 mol·L-1
0.3 mol·L-1 ![]() =9.6g,选项C错误;D、根据反应原理,加入氢氧化钠溶液反应后除产生沉淀外,所得溶液应为硫酸钠溶液,则根据钠原子和硫原子守恒,原溶液中含有的硫酸根的物质的量为0.5 mol,则向溶液X中加入0.2 L 5 mol·L-1 NaOH溶液可使溶液中的金属离子完全沉淀,选项D错误。答案选B。
=9.6g,选项C错误;D、根据反应原理,加入氢氧化钠溶液反应后除产生沉淀外,所得溶液应为硫酸钠溶液,则根据钠原子和硫原子守恒,原溶液中含有的硫酸根的物质的量为0.5 mol,则向溶液X中加入0.2 L 5 mol·L-1 NaOH溶液可使溶液中的金属离子完全沉淀,选项D错误。答案选B。

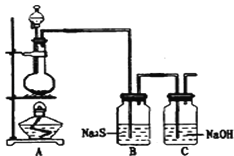
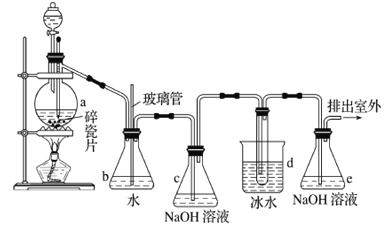
【题目】1,2-二溴乙烷可作抗爆剂的添加剂。如图为实验室制备1,2-二溴乙烷的装罝图, 图中分液漏斗和烧瓶a中分别装有浓H2SO4和无水乙醇,d装罝试管中装有液溴。
已知:CH3CH2OH![]() CH2=CH2↑+H2O;2CH3CH2OH
CH2=CH2↑+H2O;2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
相关数据列表如下:
乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
密度/g·cm-3 | 0.79 | 2.18 | 0.71 | 3.10 |
沸点/℃ | 78.5 | 131.4 | 34.6 | 58.8 |
熔点/℃ | -114.3 | 9.79 | - 116.2 | -7.2 |
水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
(1)实验中应迅速将温度升高到170℃左右的原因是______________________________。
(2)安全瓶b在实验中有多重作用。其一可以检查实验进行中d装罝中导管是否发生堵塞,请写出发生堵塞时瓶b中的现象:_______________________________;如果实验时d装罝中导管堵塞,你认为可能的原因是_______________________________________________;安全瓶b还可以起到的作用是__________________。
(3)容器c、e中都盛有NaOH溶液,c中NaOH溶液的作用是________________________________。
(4)除去产物中少量未反应的Br2后,还含有的主要杂质为___________,要进一步提纯,下列操作中必需的是_____________ (填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)实验中也可以撤去d装罝中盛冰水的烧杯,改为将冷水直接加入到d装罝的试管中,则此时冷水除了能起到冷却1,2-二溴乙烷的作用外,还可以起到的作用是____________________________。
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。有关物质的部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易与水反应,产生大量白雾 ②易分解:SO2Cl2 |
H2SO4 | 10.4 | 338 | 吸水性且不易分解 |
实验室用干燥而纯净的二氧化硫和氯气合成硫酰氯,装置如图所示(夹持仪器已省略),请回答有关问题:
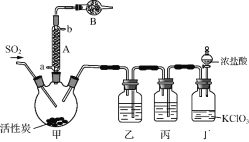
(1) 仪器A冷却水的进口_______(填“a”或“b”)。
(2) 仪器B中盛放的药品是_______。
(3) 实验所需二氧化硫用亚硫酸钠与硫酸制备,该反应的离子方程式为_______,以下与二氧化硫有关的说法中正确的是_______。
A.因为SO2具有漂白性,所以它能使品红溶液、溴水、酸性KMnO4溶液、石蕊试液褪色
B.能使品红溶液褪色的物质不一定是SO2
C.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
E.可用浓硫酸干燥SO2
F.可用澄清的石灰水鉴别SO2和CO2
(4) 装置丙所盛试剂为_______,若缺少装置乙,则硫酰氯会损失,该反应的化学方程为______________。
(5) 少量硫酰氯也可用氯磺酸(ClSO3H)分解获得,该反应的化学方程式为:2ClSO3H===H2SO4+SO2Cl2,此方法得到的产品中会混有硫酸。
①从分解产物中分离出硫酰氯的方法是______________。
②请设计实验方案检验产品中有硫酸(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液)____。
【题目】工业上用苯和1,2—二氯乙烷制联苄的反应原理如下
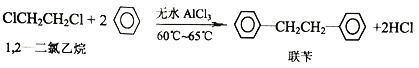
实验室制取联苄的装置如图所示(加热和夹持仪器略去)
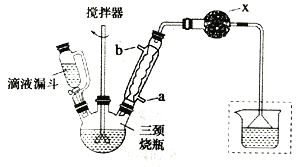
实验步骤:
①在三颈烧瓶中加入120.0mL苯和适量无水AlCl3,由滴液漏斗滴加10.0mL 1,2-二氯乙烷,控制反应温度在60~65℃,反应约60min。
②将反应后的混合物依次用2%Na2CO3溶液和水洗涤,在所得产物中加入少量无水MgSO4固体,静置、过滤,蒸馏收集一定温度下的馏分,得联苄18.2g。
相关物理常数和物理性质如下表:
名称 | 相对分子质量 | 密度/g·cm-3 | 熔点/℃ | 沸点/℃ | 溶解性 |
苯 | 78 | 0.88 | 5.5 | 80.1 | 难溶于水,易溶于乙醇 |
1,2-二氯乙烷 | 99 | 1.27 | -35.3 | 83.5 | 难溶于水,可溶于苯 |
联苄 | 182 | 0.98 | 52 | 284 | 难溶于水,易溶于苯 |
(1)和普通分液漏斗相比,使用滴液漏斗的优点是_______________________;球形冷凝管进水口是____________(选填“a”或“b”)
(2)仪器X的名称是________________;装置中虚线部分的作用是____________。
(3)洗涤操作中,用2%Na2CO3溶液洗涤的目的是___________;水洗的目的是____________。
(4)在进行蒸馏操作时,应收集____________℃的馏分。
(5)该实验中,联苄的产率约为____________%(小数点后保留两位)。