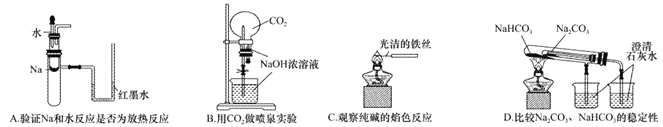
题目内容
【题目】捕集、利用CO2是人类可持续发展的重要战略之一。
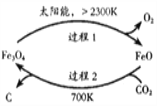
(1)用太阳能工艺捕获CO2可得炭黑,其流程如图所示:
①捕获1molCO2转移电子的物质的量是_________。
②过程2反应的化学方程式是__________。
(2)将CO2催化加氢可合成低碳烯烃:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
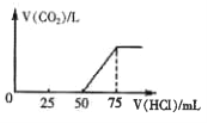
按投料比n(CO2) : n(H2)=1:3将CO2与H2充入密闭容器,在0.1MPa时,测得平衡时四种气态物质,其温度(T)与物质的量(n)的关系如图所示。
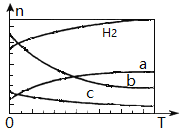
①正反应的焓变△H_______0 。
②提高CO2的转化率,可采用的方法是_______。
A.减小n(CO2)与n(H2)的投料比
B.改变催化剂
C.缩小容器体积
③图中表示乙烯的曲线是_______。
(3)以NH3与CO2为原料,合成尿素[化学式:CO(NH2)2]:
反应如下:①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJ/mol
③H2O(l)=H2O(g) △H=+44.0kJ/mol
CO2与NH3形成液态水时,合成尿素的热化学方程式是_______________;
(2)电解CO2可制得多种燃料:下图是在酸性电解质溶液中,以惰性材料做电极,将CO2转化为丙烯的原理模型。
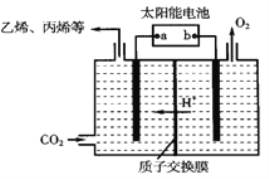
①太阳能电池的负极是_________。
②生成丙烯的电极反应式是__________。
【答案】 4mol 6FeO + CO2 = 2Fe3O4 + C △H<0 ac c 2NH3(g)+CO2(g)= CO(NH2)2(s)+ H2O(l) △H = -87kJ/mol a 3CO2 + 18H+ + 18e- = CH2=CH-CH3 + 6H2O
【解析】(1)①捕获1molCO2生成1molC,化合价从+4价升高到0价,因此转移电子的物质的量是4mol。②过程2反应是氧化亚铁被CO2氧化为四氧化三铁,反应的化学方程式是6FeO+CO2 = 2Fe3O4 + C。(2)①随着温度的升高,氢气的物质的量增加,说明升高温度平衡向逆反应方向进行,则正反应的焓变△H<0。②A.减小n(CO2)与n(H2)的投料比,相当于增大氢气浓度,有利于提高CO2转化率,A正确;B.改变催化剂不能改变平衡状态,转化率不变,B错误;C.正反应体积减小,缩小容器体积,压强增大,平衡向正反应方向进行,转化率升高,C正确,答案选AC。③乙烯是生物物,物质的量小于水蒸气,所以图中表示乙烯的曲线是c。(3)已知:① 2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-159.5kJ/mol,②NH2CO2NH4(s) = CO(NH2)2(s)+ H2O(g) △H=+116.5kJ/mol,③H2O(l)= H2O(g) △H=+44.0kJ/mol,则根据盖斯定律可知①+②-③即得到合成尿素的热化学方程式是2NH3(g)+CO2(g)= CO(NH2)2(s)+ H2O(l) △H = -87kJ/mol;(4)①与电源b相连的产生氧气,氢氧根放电,说明该电极是阳极,b是正极,则太阳能电池的负极是a。②丙烯在阴极产生,则生成丙烯的电极反应式是3CO2 +18H+ +18e- = CH2=CH-CH3 + 6H2O。