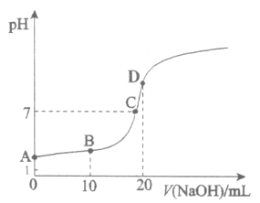
题目内容
【题目】二甲醚作为燃料电池的原料,可通过以下途径制取:
I.2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g) ΔH
CH3OCH3(g)+H2O(g) ΔH
II.2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH
CH3OCH3(g)+3H2O(g) ΔH
(1)已知:①CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
CO2(g)+H2(g) ΔH1=-41.0kJ·mol-1
②CO2(g)+3H2(g)![]() CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
CH3OH(g)+ H2O(g) ΔH2=-49.0kJ·mol-1
③CH3OCH3(g)+ H2O(g)![]() 2CH3OH(g) ΔH3=+23.5kJ·mol-1
2CH3OH(g) ΔH3=+23.5kJ·mol-1
则反应I的ΔH=_______kJ·mol-1
(2)在恒容密闭容器里按体积比为1:2充入一氧化碳和氢气发生反应2CO(g)+4H2(g)![]() CH3OCH3(g)+H2O(g),一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是________。
CH3OCH3(g)+H2O(g),一定条件下反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向正反应方向移动的是________。
A.新平衡后c(CH3OCH3)增大
B.正反应速率先增大后减小
C.反应物的体积百分含量减小
D.化学平衡常数K值增大
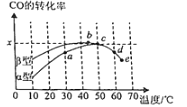
(3)在10L恒容密闭容器中,均充入4molCO2和7molH2,分别以铱(Ir)和铈(Ce)作催化剂,通过反应II:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)制二甲醚,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图所示。
CH3OCH3(g)+3H2O(g)制二甲醚,反应进行相同的时间后测得的CO2的转化率α(CO2)随反应温度的变化情况如图所示。
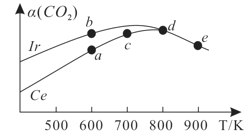
①根据图1,下列说法不正确的是________。
A.反应II的ΔH<0,ΔS>0
B.600K时,H2的速率:v(b)正>v(a)逆
C.分别用Ir、Ce作催化剂时,Ce使反应II的活化能降低更多
D.从状态d到e,α(CO2)减小的原因可能是温度升高平衡逆向移动
②状态e(900K)时,α(CO2)=50%,则此时的平衡常数K=______(保留3位有效数字)。
(4)写出二甲醚碱性(电解质溶液为KOH溶液)燃料电池的负极电极反应式__________。该电池工作时,溶液中的OH-向______极移动,该电池工作一段时间后,测得溶液的pH减小。
(5)己知参与电极反应的电极材料单位质量放出电能的大小称为该电池的比能量.关于二甲醚碱性燃料电池与乙醇碱性燃料电池,下列说法正确的是________。
A.两种燃料互为同分异构体,分子式和摩尔质量相同,比能量相同
B.两种燃料所含共价键数目相同,断键时所需能量相同,比能量相同
C.两种燃料所含共价键类型不同,断键时所需能量不同,比能量不同
【答案】-203.5 BD A、C 6.75×104 CH3OCH3+16OH--12e-=2CO32-+11H2O 负极 C
【解析】
(1)根据盖斯定律,①×2+②×2-③可得反应I,所以△H=(-41.0 kJmol-1)×2+(-49.0kJmol-1)×2-(+23.5kJmol-1)=-203.5kJmol-1;
(2)A.向平衡体系中再充入一定量的CH3OCH3气体,平衡逆向移动,但新平衡c(CH3OCH3)增大,故A不选;
B.正反应速率先增大后减小说明正反应速率大于逆反应速率,平衡正向移动,故B选;
C.移走反应物可以使反应物的体积百分含量减小,但平衡会逆向移动,故C不选;
D.该反应焓变小于零,正反应为放热反应,K值增大说明温度降低,降低温度会使平衡正向移动,故D选;
综上所述选BD;
(3)据图可知随温度上升二氧化碳的转化率先上升后下降,说明在温度较低时相同时间内反应还未达到平衡,平衡后随温度上升二氧化碳转化率随温度上升而下降;
①A.由图中信息可知,当温度高于800K时,CO2转化率α(CO2)随反应温度升高而减小,说明该反应为放热反应,△H>0,同时该反应气体体积减小,△S<0,故A错误;
B.由图可知,b点CO2转化率α(CO2)大于a点,所以生成物浓度b点大于a点,故v(b)逆>v(a)逆,由于b点未平衡且正向进行,v(b)正>v(b)逆,所以v(b)正>v(a)逆,故B正确;
C.由图中信息可知,当温度为400K~800K时,反应进行相同时间后测得Ir作催化剂的CO2转化率α(CO2)较高,说明Ir的催化效率更高,所以用Ir、Ce作催化剂时,反应的活化能降低更多的是Ir,故C错误;
D.状态d、e都是平衡状态,从d到e,该反应为放热反应,升温平衡逆向移动,α(CO2)减小,故D正确。
故答案为:AC;
②初始投料为4molCO2和7molH2,状态e(900K)时,α(CO2)=50%,则转化的CO2为2mol,列三段式有:

容器的体积为10L,则平衡常数K=![]() =6.75×104;
=6.75×104;
(4)二甲醚燃料电池中二甲醚被氧化生成二氧化碳,所以通入二甲醚的电极为负极,得电子发生还原反应,由于电解质为KOH溶液,所以最终产物为碳酸根,电极方程式为:CH3OCH3+16OH--12e-=2CO32-+11H2O;该电池工作时为原电池,原电池中阴离子流向负极;
(5)不同的化学键断裂或形成时的能量变化不同,二甲醚和乙醇虽然为同分异构体且摩尔质量相同,但分子中化学键类型不同,所以单位质量的二甲醚和乙醇反应过程中放出的能量不同,所以C正确。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】葡萄酒中的酒精是葡萄果实中的糖发酵后的产物(C6H12O6![]() 2CH3CH2OH+2CO2↑)。
2CH3CH2OH+2CO2↑)。
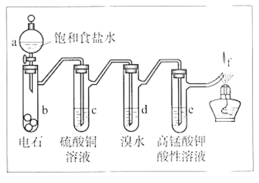
Ⅰ.已知:实验室制乙烯原理为CH3CH2OH![]() CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
CH2=CH2↑+H2O,产生的气体能使Br2的四氯化碳溶液褪色,甲、乙同学用下列实验验证。(气密性已检验,部分夹持装置略)。实验操作和现象:
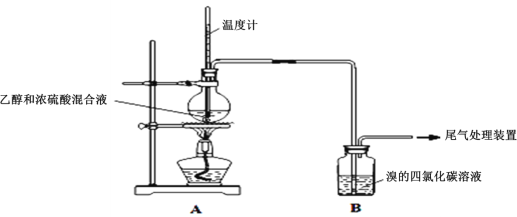
操作 | 现象 |
点燃酒精灯,加热至170℃ | Ⅰ:A中烧瓶内液体渐渐变黑 Ⅱ:B内气泡连续冒出,溶液逐渐褪色 |
…… | |
实验完毕,清洗烧瓶 | Ⅲ:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
(1)溶液“渐渐变黑”,说明浓硫酸具有___性。
(2)对产生的气体进行分析,甲认为是C2H4,乙认为不能排除SO2的作用。
①写出实验室制取SO2的化学反应方程式是___;
②乙根据现象认为实验中产生的SO2和___,使B中有色物质反应褪色。
③为证实各自观点,甲、乙重新实验,设计与现象如下:
甲:在A、B间增加一个装有某种试剂的洗气瓶;现象:Br2的CCl4溶液褪色。
乙:用下列装置按一定顺序与A连接:(尾气处理装置略)
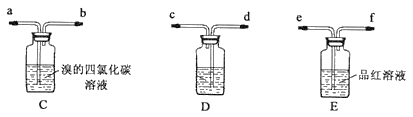
现象:C中溶液由红棕色变为浅红棕色时,E中溶液褪色。
请回答下列问题:
a.甲设计实验中A、B间洗气瓶中盛放的试剂是___;乙设计的实验D中盛放的试剂是___,装置连接顺序为___ (用仪器接口字母编号)。
b.能说明确实是SO2使E中溶液褪色的实验是___。
c.乙为进一步验证其观点,取少量C中溶液,加入几滴BaCl2溶液,振荡,产生大量白色沉淀,浅红棕色消失,发生反应的离子方程式是___。由此可得出的干燥的SO2不能使Br2的四氯化碳溶液褪色。
Ⅱ.葡萄酒中常用Na2S2O5做抗氧化剂。
(3)0.5molNa2S2O5溶于水配成1L溶液,该溶液的pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化如图所示。写出Na2S2O5溶于水时溶液中离子浓度由大到小的排列顺序___。
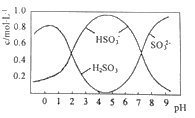
(4)已知:Ksp[BaSO4]=1×10-10,Ksp[BaSO3]=5×10-7。把部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO42-沉淀完全[c(SO42-)≤1×10-5mol·L-1],此时溶液中c(SO32-)≤___mol·L-1。