题目内容
9.一定温度下,反应N2(g)+3H2(g)?2NH3(g)达到化学平衡状态的标志是( )| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | 单位时间里每增加1molN2,同时减少2mol NH3 | |
| D. | 单位时间里每增加1molN2,同时增加3molH2 |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:A.N2、H2和NH3的质量分数不再改变,说明正逆反应速率相等,该反应达到平衡状态,故A正确;
B.c(N2):c(H2):c(NH3)=1:3:2的状态不一定是平衡状态,与反应物初始浓度及转化率有关,所以不能据此判断平衡状态,故B错误;
C.无论反应是否达到平衡状态,都存在单位时间里每增加1molN2、同时减少2mol NH3,所以不能据此判断平衡状态,故C错误;
D.无论反应是否达到平衡状态,都存在单位时间里每增加1molN2、同时增加3molH2,所以不能据此判断平衡状态,故D错误;
故选A.
点评 本题考查化学平衡状态判断,为高频考点,只有反应前后改变的物理量不变时该反应就达到平衡状态,易错选项是B.

练习册系列答案
相关题目
9.用NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 用石墨作电极电解饱和食盐水时,若阴极得到2NA个电子,则阳极产生22.4L气体 | |
| B. | 常温常压下,Na2O2与足量H2O反应,共生成0.2mol O2,转移的电子数目是0.8NA | |
| C. | 1L 1mol/L的K2CO3溶液中离子总数小于3NA | |
| D. | 室温下,42.0g 乙烯和丙烯的混合气体中含有的碳原子数为3NA |
20.机物A的结构如图所示,下列说法正确的是( )


| A. | 一定条件下和浓溴水反应时,1mol A能消耗3molBr2 | |
| B. | 一定条件下,1mol A能和5mol氢气发生加成反应 | |
| C. | 一定条件下,1mol A能与3molNaOH反应 | |
| D. | A能与碳酸氢钠溶液反应 |
17.设NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 28g乙烯的气体中含有H原子数为2NA | |
| B. | 标准状况下,2.24L乙醇与足量Na反应生成H2分子数0.05NA | |
| C. | 每摩尔-OH中含电子数目为9NA | |
| D. | 每摩尔苯中含有的碳碳双键的数目为3NA |
4.元素周期表是元素周期律的具体表现形式.下列说法正确的是( )
| A. | 第二周期元素的最高正价从左向右依次从+1递增到+7价 | |
| B. | 同一周期从左到右,元素的金属性逐渐增强、非金属性逐渐减弱 | |
| C. | 第IA元素全部是金属元素 | |
| D. | 可在金属与非金属分界线附近寻找半导体材料 |
14.关于下列图示的说法中正确的是( )
| A. |  用如图所示实验可比较氯、碳、硅三种元素的非金属性强弱 | |
| B. | 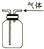 用如图所示实验装置通过排空气法收集C2H4气体 | |
| C. |  如图所示装置可用于制取乙酸乙酯,分液漏斗中装的是乙醇 | |
| D. | 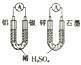 如图两个装置中提供导线的电子数相同时,生成H2的物质的量也相同 |
1.Ca(OH)2溶解度随温度变化曲线如图,下列说法错误的是( )


| A. | a点溶液升高温度后会出现浑浊 | |
| B. | 30℃时Ca(OH)2溶液的浓度一定大于60℃时的浓度 | |
| C. | 30℃时Ca(OH)2的Ksp约等于3.2×10-5 | |
| D. | 若在a点溶液中加入CaO溶液中溶质质量将减少 |
18.下列关于碳氢化合物的叙述正确的是( )
| A. | 碳氢化合物的通式为CnH2n+2 | |
| B. | 烷烃中都有碳碳单键 | |
| C. | 烷烃分子中的碳原子只能在一条链上,不能出现支链 | |
| D. | 烷烃分子中可能出现n个甲基(n=1,2,3…) |
19.下列叙述正确的是( )
| A. | 直径介于1nm~100nm之间的微粒称为胶体 | |
| B. | 电泳现象可证明胶体属于电解质溶液 | |
| C. | 胶体粒子很小,可以透过半透膜 | |
| D. | 利用丁达尔效应可以区别溶液与胶体 |