��Ŀ����
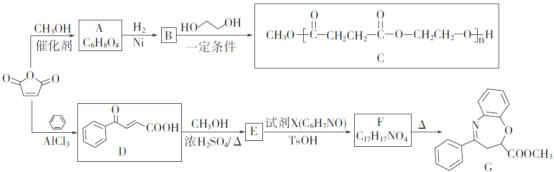
����Ŀ��![]() ��һ����Ҫ�Ļ���ԭ�ϣ������ںϳɿɽ���ĸ߾���C�Լ�������ҩ��G��
��һ����Ҫ�Ļ���ԭ�ϣ������ںϳɿɽ���ĸ߾���C�Լ�������ҩ��G��
��֪��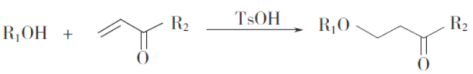
(1)A���еĹ�����������______________��
(2)D��E�ķ�Ӧ������_____________________��
(3)E�ķ���ʽ��____________��F�Ľṹ��ʽ��_________________��
(4)B��C�Ļ�ѧ����ʽΪ________________________________________��
(5)W��B��ͬ���칹�壬0.5mol W������̼��������Һ��Ӧ����44g CO2��W����______��(�����������칹)�����к˴Ź�������Ϊ�����Ľṹ��ʽΪ___________��
(6)����ɼױ���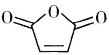 Ϊԭ���Ʊ�������
Ϊԭ���Ʊ�������![]() �ĺϳ�·��(���Լ���ѡ)______��
�ĺϳ�·��(���Լ���ѡ)______��
���𰸡�̼̼˫�������� ������Ӧ��ȡ����Ӧ�� C11H10O3 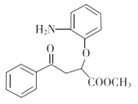 nCH3OOCH2CH2COOCH3+nHOCH2CH2OH
nCH3OOCH2CH2COOCH3+nHOCH2CH2OH![]()
![]() +(2n-1)CH3OH 9
+(2n-1)CH3OH 9 ![]()
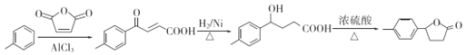
��������
�ɺϳ����̿�֪��![]() ��״�������Ϣ�еķ�Ӧ����AΪ
��״�������Ϣ�еķ�Ӧ����AΪ![]() ��A�����������ӳɷ�Ӧ����BΪ
��A�����������ӳɷ�Ӧ����BΪ![]() ��HOCH2CH2OH��B�������۷�Ӧ���ɵ�CΪ
��HOCH2CH2OH��B�������۷�Ӧ���ɵ�CΪ![]() ��
��![]() �뱽���Ȼ��������·�Ӧ����D��Ϊ
�뱽���Ȼ��������·�Ӧ����D��Ϊ![]() ��D��״�����������Ӧ����EΪ
��D��״�����������Ӧ����EΪ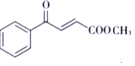 ��E������Ϣ�еķ�Ӧ����F���Լ�XΪ
��E������Ϣ�еķ�Ӧ����F���Լ�XΪ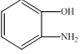 ������FΪ
������FΪ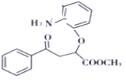 �����F�ڼ��������·���ȡ����Ӧ����GΪ
�����F�ڼ��������·���ȡ����Ӧ����GΪ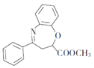 ��
��
(1) AΪ![]() �����еĹ�����������������̼̼˫����
�����еĹ�����������������̼̼˫����
(2) D��״�����������Ӧ���� ����D��E�ķ�Ӧ������������Ӧ��ȡ����Ӧ��
����D��E�ķ�Ӧ������������Ӧ��ȡ����Ӧ��
(3)EΪ �������ʽ��C11H10O3���ɷ�����֪F�Ľṹ��ʽ��
�������ʽ��C11H10O3���ɷ�����֪F�Ľṹ��ʽ�� ��
��
(4) HOCH2CH2OH��B�������۷�Ӧ���ɵ�CΪ![]() ��������Ӧ�Ļ�ѧ����ʽΪ
��������Ӧ�Ļ�ѧ����ʽΪ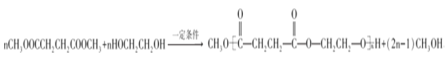 ��
��
(5) BΪ![]() ����ͬ���칹��W 0.5mol������̼��������Һ��Ӧ����44gCO2��CO2�����ʵ����ʵ���Ϊ1mol��˵��W���ӽṹ�к���2���Ȼ�����ȥ2��-COOH������4��C�����ĸ�̼��Ϊֱ��״��C-C-C-C������2��-COOH������6�ֽṹ�������ĸ�̼�п�����һ��֧������
����ͬ���칹��W 0.5mol������̼��������Һ��Ӧ����44gCO2��CO2�����ʵ����ʵ���Ϊ1mol��˵��W���ӽṹ�к���2���Ȼ�����ȥ2��-COOH������4��C�����ĸ�̼��Ϊֱ��״��C-C-C-C������2��-COOH������6�ֽṹ�������ĸ�̼�п�����һ��֧������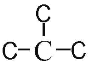 ������2��-COOH������3�ֽṹ��������������B��ͬ���칹��W����9�֣����к˴Ź�������Ϊ�����Ľṹ��ʽΪ
������2��-COOH������3�ֽṹ��������������B��ͬ���칹��W����9�֣����к˴Ź�������Ϊ�����Ľṹ��ʽΪ![]() ��
��
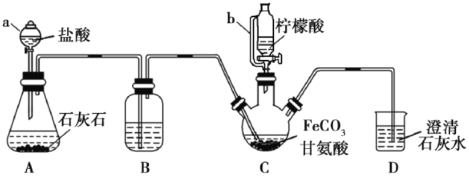
(6)�����������D�ķ�Ӧԭ���ױ���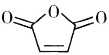 ������
������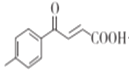 ��
�� ����H2�ڴ��������·����ӳɷ�Ӧ������
����H2�ڴ��������·����ӳɷ�Ӧ������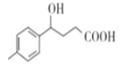 ��
�� ����Ũ����������¼��ȷ���������Ӧ��������
����Ũ����������¼��ȷ���������Ӧ��������![]() ������ϳ�·��Ϊ
������ϳ�·��Ϊ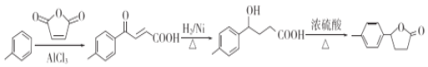 ��
��

 ��ĩ100�ִ��غ�������ϵ�д�
��ĩ100�ִ��غ�������ϵ�д� Сѧ�������Ծ�ϵ�д�
Сѧ�������Ծ�ϵ�д�����Ŀ��ijѧϰС��Ϊ��̽��BrO3-+5Br-+6H+![]() 3Br2+3H2O��Ӧ����(v)�뷴Ӧ��Ũ�ȵĹ�ϵ,��20�����ʵ��,���õ��������±�:
3Br2+3H2O��Ӧ����(v)�뷴Ӧ��Ũ�ȵĹ�ϵ,��20�����ʵ��,���õ��������±�:
ʵ���� ����Ũ�� | �� | �� | �� | �� | �� |
c(H+)/mol��L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
c(BrO3-)/mol��L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
c(Br-)/mol��L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
v/mol��L-1��s-1 | 2.4��10-8 | 4.8��0-8 | 1.2��10-8 | 4.8��10-8 | v1 |
���н�����ȷ����
A. ��Ӧ��BrO3-��Br-��H+��Ũ�ȶԸ÷�Ӧ���ʵ�Ӱ��̶���ȫ��ͬ
B. ʵ��ڡ���,̽������c(BrO3-)�Է�Ӧ���ʵ�Ӱ��
C. ���÷�Ӧ���ʷ���Ϊv=kca(BrO3-)cb(Br-)cc(H+)(kΪ����),��c=1
D. ʵ�����,v1=4.8��10-8
����Ŀ��25�� ʱ��������ĵ���ƽ�ⳣ�����£�
��ѧʽ | CH3COOH | H2CO3 | HClO |
����ƽ�ⳣ�� | 1.8��10��5 | K1��4.3��10��7 K2��5.6��10��11 | 3.0��10��8 |
�ش��������⣺
(1)һ������£����¶�����ʱ��Ka________(����������������С������������)��
(2)�����������ӽ�����������ɴ�С��˳����___________________(����ĸ)��
a.CO32�� b.ClO�� c.CH3COO�� d.HCO3��
(3)���з�Ӧ���ܷ�������________(����ĸ)��
a. 2ClO����CO2��H2O �� CO32����2HClO
b. ClO����CH3COOH �� CH3COO����HClO
c. CO32����2HClO �� CO2����H2O��2ClO��
d. CO32����2CH3COOH �� 2CH3COO����CO2����H2O
(4)������ˮϡ��0.10mol��L-1�Ĵ��ᣬ���и�ʽ��ʾ����ֵ��ˮ�������Ӷ��������________(����ĸ)��
a.c(CH3COOH)/c(H+) b.c(CH3COO��)/c(CH3COOH) c.c(H+)/Ka d.c(H+)/c(OH-)
(5)�����Ϊ10 mL��pH��Ϊ2�Ĵ�����Һ��HX��Һ�ֱ��ˮϡ����1000 mL��ϡ������pH�仯��ͼ��ʾ��

�����ĵ���ƽ�ⳣ��________(����>������=������<������ͬ)HX�ĵ���ƽ�ⳣ����ϡ�ͺ�����Һ��ˮ���������c(H��)____ HX��Һ��ˮ���������c(H��)����ͬŨ�ȵ�NaOH��Һ�ֱ��к�������������Һ��ǡ���к�ʱ����NaOH��Һ�����������________HX��
(6)25��ʱ�������CH3COOH��CH3COONa�Ļ����Һ��pH��6������Һ��c(CH3COO��)-c(Na��)��________mol��L-1(�ȷ��ֵ)��