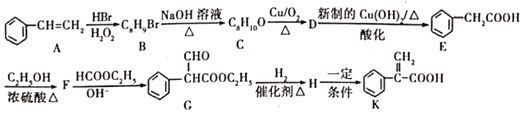
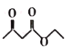
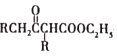题目内容
【题目】机动车排放的污染物主要有碳氢化合物、一氧化碳和氮氧化物等。
I.汽油燃油车上安装三元催化转化器,可有效降低汽车尾气污染。
(1)已知:C(s)+O2(g) == CO2(g) △H1 = 393.5kJ·mol1
2C(s)+O2(g) == 2CO(g) △H2 = 221.0 kJ·mol1
N2(g)+O2(g) == 2NO(g) △H 3 = +180.5 kJ·mol1
CO和NO两种尾气在催化剂作用下生成N2(g)的热化学方程式是______。
(2)研究CO和NO的催化反应,用气体传感器测得在某温度下、一定体积的密闭容器中,不同时间NO和CO浓度如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/(104mol·L1) | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
c(CO)/(103mol·L1) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
①前4 s内的平均反应速率υ(CO) =______mol·L1·s1。
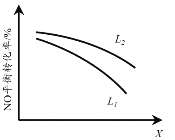
②L、X可分别代表压强或温度。下图表示L一定时,NO(g)的平衡转化率随X的变化关系。X代表的物理量是______。判断L1、L2的大小关系,并简述理由:______。
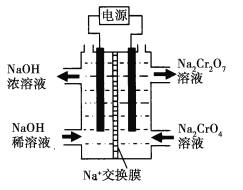
II.柴油燃油车是通过尿素-选择性催化还原(Urea-SCR)法处理氮氧化物。
Urea-SCR的工作原理为:尿素[CO(NH2)2]水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解,产生 NH3,生成的NH3与富氧尾气混合后,加入适合的催化剂,使氮氧化物得以处理。
(3)尿素水解的化学方程式是______。
(4)下图为在不同投料比[n(尿素)/n(NO)]时NO转化效率随温度变化的曲线。
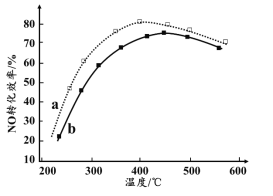
① 尿素与NO物质的量比a______b(填“>”、“=”或“<”)
② 由图可知,温度升高,NO转化效率升高,原因是______。温度过高,NO转化效率下降,NO的浓度反而升高,可能的原因是______(写出一种即可)。
【答案】2NO(g)+2CO(g) == N2(g)+2CO2(g) △H == 746.5 kJ·mol1 2.25 ×104 温度 L2>L1,该反应为气体体积减小的反应,压强增大,NO转化率增大 CO(NH2)2+H2O![]() 2NH3+CO2 > 随着温度升高,尿素水解释放氨气的速率加快,c(NH3)增大;温度升高,催化剂活性增加,都导致化学反应速率加快 当温度过高,发生反应 4NH3+5O2 ==== 4NO+6H2O,生成NO等
2NH3+CO2 > 随着温度升高,尿素水解释放氨气的速率加快,c(NH3)增大;温度升高,催化剂活性增加,都导致化学反应速率加快 当温度过高,发生反应 4NH3+5O2 ==== 4NO+6H2O,生成NO等
【解析】
I.(1)已知:①C(s)+O2(g) == CO2(g) △H1 = 393.5kJ·mol1,②2C(s)+O2(g) == 2CO(g) △H2 = 221.0 kJ·mol1 ,③N2(g)+O2(g) == 2NO(g) △H 3 = +180.5 kJ·mol1,由盖斯定律可知①×2-②-③得2NO(g)+2CO(g) == N2(g)+2CO2(g),由此计算此反应的△H;
(2)①根据υ(CO)=![]() 计算前4 s内的平均反应速率υ(CO);
计算前4 s内的平均反应速率υ(CO);
②图中L一定时,NO(g)的平衡转化率随X的增大,转化率降低,说明逆向进行,结合反应2NO(g)+2CO(g) == N2(g)+2CO2(g) △H==746.5 kJ·mol1升高温度时平衡逆向进行,增大压强时平衡正向进行分析;
II.(3)尿素[CO(NH2)2]水溶液温度高于160℃时尿素水解,产生 NH3,根据质量守恒可知,同时有CO2气体生成,结合守恒法写出尿素水解的化学方程式;
(4)①反应中,增大一种反应物的量可提高另一种反应物的转化率;
②温度升高有利于尿素水解生成NH3,且提高催化剂的活性,催化效果好;NH3在加热条件下催化氧化能生成NO。
I.(1)已知:①C(s)+O2(g) == CO2(g) △H1 = 393.5kJ·mol1,②2C(s)+O2(g) == 2CO(g) △H2 = 221.0 kJ·mol1 ,③N2(g)+O2(g) == 2NO(g) △H 3 = +180.5 kJ·mol1,由盖斯定律可知①×2-②-③得2NO(g)+2CO(g) == N2(g)+2CO2(g),则△H=2(△H1)-(△H2)-(△H3)=2( 393.5kJ·mol1)-( 221.0 kJ·mol1)-(+180.5 kJ·mol1),故CO和NO两种尾气在催化剂作用下生成N2(g)的热化学方程式是2NO(g)+2CO(g) == N2(g)+2CO2(g) △H==746.5 kJ·mol1;
(2)①前4 s内的平均反应速率υ(CO)=![]() =
=![]() mol·L1·s1=2.25×104mol·L1·s1;
mol·L1·s1=2.25×104mol·L1·s1;
②图中L一定时,NO(g)的平衡转化率随X的增大,转化率降低,说明逆向进行,结合反应2NO(g)+2CO(g) == N2(g)+2CO2(g) △H==746.5 kJ·mol1升高温度时平衡逆向进行,增大压强时平衡正向进行,可知X代表的物理量是温度;当温度一定时,增大压强,平衡正向移动,NO的转化率增大,故L2>L1;
II.(3)尿素[CO(NH2)2]水溶液温度高于160℃时尿素水解,产生 NH3,根据质量守恒可知,同时有CO2气体生成,则尿素水解的化学方程式为CO(NH2)2+H2O![]() 2NH3+CO2;
2NH3+CO2;
(4)①增大尿素的量可提高NO的转化率,即尿素与NO物质的量比值越大,NO的转化率越大,则图象中a>b;
②由图可知,随着温度升高,尿素水解释放氨气的速率加快,c(NH3)增大,且温度升高,催化剂活性增加,导致化学反应速率加快,故温度升高,NO转化效率升高;但温度过高,
,原因是______。温度过高,发生反应 4NH3+5O2 ==== 4NO+6H2O,生成NO,导致NO浓度升高,NO转化效率下降。

【题目】25℃ 时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合质子能力由大到小的顺序是___________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. 2ClO-+CO2+H2O = CO32-+2HClO
b. ClO-+CH3COOH = CH3COO-+HClO
c. CO32-+2HClO = CO2↑+H2O+2ClO-
d. CO32-+2CH3COOH = 2CH3COO-+CO2↑+H2O
(4)用蒸馏水稀释0.10mol·L-1的醋酸,下列各式表示的数值随水量的增加而增大的是________(填字母)。
a.c(CH3COOH)/c(H+) b.c(CH3COO-)/c(CH3COOH) c.c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如图所示。

则醋酸的电离平衡常数________(填“>”、“=”或“<”,下同)HX的电离平衡常数;稀释后,醋酸溶液中水电离出来的c(H+)____ HX溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸________HX。
(6)25℃时,若测得CH3COOH与CH3COONa的混合溶液的pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。