题目内容
5.有关有机物结构和性质的说法中正确的是( )| A. | 将乙烯通入溴水中、苯与溴水混合,两种情况下“溴水层”都褪色,且原理相同 | |
| B. | 有机物  的分子式为C6H10Br2 的分子式为C6H10Br2 | |
| C. | CH2=CH2、 、 、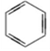 三种物质中都含有碳碳双键,都可发生加成反应 三种物质中都含有碳碳双键,都可发生加成反应 | |
| D. | 通过乙烷与少量的Cl2发生取代反应可制取较纯净的CH3CH2Cl |
分析 A.乙烯与溴水发生加成反应,苯与溴水发生萃取;
B.根据结构简式确定含有的原子个数,可确定分子式;
C.苯环不含碳碳双键;
D.烷烃与氯气的取代反应可生成多种卤代烃.
解答 解:A.乙烯与溴水发生加成反应,苯与溴水发生萃取,二者褪色原理不同,故A错误;
B.由结构简式可知有机物  的分子式为C6H10Br2,故B正确;
的分子式为C6H10Br2,故B正确;
C.苯环不含碳碳双键,但可发生加成反应,故C错误;
D.乙烷与少量的Cl2发生取代反应为链锁式取代反应,产物复杂,不能制备纯净的CH3CH2Cl,应选加成反应制备,故D错误.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握有机物的性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意选项B为解答的难点,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
6.下列各组的两种物质属于同素异形体的是( )
| A. | ${\;}_{6}^{12}$C和${\;}_{6}^{13}$C | B. | 红磷和白磷 | ||
| C. | 丁烷和异丁烷 | D. | ${\;}_{19}^{40}$K和${\;}_{20}^{40}$Ca |
13.下列叙述正确的是( )
| A. | 常温下向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| B. | 常温下向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| C. | 常温下向水中加入少量固体CH3COONa,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 常温下将水加热,Kw不变 |
20.已知NH3、H2S等分子是极性分子,CO2、BF3、CCl4等分子是由极性键构成的非极性分子,据以上事实,可推出ABn型分子是非极性分子的经验规律( )
| A. | 分子中不能含有氢原子 | |
| B. | 在ABn型分子中A的相对原子质量应小于B的相对原子质量 | |
| C. | 在ABn型分子中A原子最外层没有孤对电子,即价电子全部成键 | |
| D. | 分子中每个共价键的键长应相等 |
17.下列反应中属于加成反应的是( )
| A. | 乙炔通入酸性高锰酸钾溶液中,溶液褪色 | |
| B. | 苯滴入溴水中,振荡后溴水层接近无色 | |
| C. | 甲烷和氯气混合后光照,气体颜色逐渐变浅 | |
| D. | 将裂化获得的汽油滴入溴水中,溴水褪色 |
14.在一定温度下向一个体积为2L固定容积的密闭容器中充入一定量的N2O4,进行如下化学反应:N2O4(g)?2NO2(g),请回答下列问题:
(1)下列说法能够判断该反应已经达到化学平衡状态的是BD.
A.容器内混合气体密度不变
B.混合气体的压强不变
C.0.5molN2O4分解的同时有1molNO2生成
D.混合气体的颜色不变
(2)每隔一段时间对该密闭容器内的物质进行分析,得到如下数据:
①b的值为0.16;
②达到化学平衡状态时,N2O4的平衡转化率为42.9%(或42.86%);
③20s~40s内用N2O4表示该反应的平均反应速率υ(N2O4)=0.01mol•L-1•s-1.
(1)下列说法能够判断该反应已经达到化学平衡状态的是BD.
A.容器内混合气体密度不变
B.混合气体的压强不变
C.0.5molN2O4分解的同时有1molNO2生成
D.混合气体的颜色不变
(2)每隔一段时间对该密闭容器内的物质进行分析,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) (mol) | 2.80 | a | 2.00 | c | d | 1.60 |
| n(NO2) (mol) | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
②达到化学平衡状态时,N2O4的平衡转化率为42.9%(或42.86%);
③20s~40s内用N2O4表示该反应的平均反应速率υ(N2O4)=0.01mol•L-1•s-1.
15.下列离子可以大量共存的是( )
| A. | Fe3+、Na+、I-、Cl- | B. | Al3+、NO3-、Cl-、K+ | ||
| C. | K+、H+、HCO3-、SO42- | D. | Cu2+、Na+、SO42-、Cl- |

