题目内容
7.实验装置如图乙所示,装置B中盛有10.0g的Na2CO3样品[假设杂质不参加反应,原容器中CO2含量可忽略不计,各装置内反应完全.实验室可供选择的试剂盒药品还有锌粒、稀H2SO4、CaCO3、蒸馏水]
(1)装置A锥形瓶内盛有锌粒,装置A的作用装置A中产生的氢气推动装置B中的CO2气体,使装置B中的CO2气体全部被装置D中的碱石灰吸收;装置B中的分液漏斗中装有稀硫酸.
(2)若无装置C,实验的结果将偏高,(填“偏高”、“偏低”、“无影响”) 装置E的作用防止空气中的水蒸气、CO2等气体进入装置D中,使装置D中碱石灰的质量增加.
(3)若实验后,装置D的质量增加3.52g,则该样品的纯度为84.8%.
分析 (1)根据实验原料分析,锌粒反应产生H2在装置中流动,本身不参加反应,充当推动气体的作用,A装置的作用是产生H2,推动反应进行,分液漏斗中装有酸,为稀硫酸;
(2)装置C中装有浓硫酸,起到吸水的作用,若没有装置C,会导致D中质量偏高,影响到实验,装置E联通空气,主要为了防止空气中的水蒸气和CO2进入装置干扰实验;
(3)装置D中质量增加是吸收CO2的质量,根据C元素守恒计算.
解答 解:(1)根据实验原料分析,锌粒反应产生H2在装置中流动,本身不参加反应,充当推动气体的作用,A装置的作用是产生H2,推动反应进行,分液漏斗中装有酸,为稀硫酸,则装置A锥形瓶内盛有锌粒,装置A的作用为:装置A中产生的氢气推动装置B中的CO2气体,使装置B中的CO2气体全部被装置D中的碱石灰吸收,装置B中的分液漏斗中装有稀硫酸,
故答案为:锌粒;装置A中产生的氢气推动装置B中的CO2气体,使装置B中的CO2气体全部被装置D中的碱石灰吸收;稀硫酸;
(2)装置C中装有浓硫酸,起到吸水的作用,若没有装置C,会导致D中质量偏高,造成实验误差,测定出的实验结果也会偏高,装置E联通空气,主要为了防止空气中的水蒸气和CO2进入装置干扰实验,
故答案为:偏高;防止空气中的水蒸气、CO2等气体进入装置D中,使装置D中碱石灰的质量增加;
(3)装置D中质量增加是吸收CO2的质量,实验后,装置D的质量增加3.52g,则n(CO2)=$\frac{3.52g}{44g/mol}$=0.08mol,根据元素守恒,则n(Na2CO3)=n(CO2)=0.08mol,则样品的纯度为$\frac{0.08mol×106g/mol}{10.0g}×100%$=84.8%,
故答案为:84.8%.
点评 本题考查实验流程分析,结合原料分析,考虑每个装置的作用,注意元素守恒在计算中的运用,从元素的角度看问题,题目难度不大,是基础题.

| A. | 含共价键的化合物不一定是共价化合物,含离子键的化合物一定是离子化合物 | |
| B. | 非金属元素的原子之间形成的化学键一定是共价键 | |
| C. | 分子晶体中分子间作用力越大,分子越稳定 | |
| D. | 原子晶体都是由碳、硅两种元素组成 |
(1)生成物的体积分数一定增加(2)生成物的产量一定增加(3)反应物的转化率一定增大(4)反应物浓度一定降低(5)正反应速率一定大于逆反应(6)加入催化剂.
| A. | (1)(2) | B. | (2)(5) | C. | (3)(5) | D. | (4)(6) |
| A. | 陈放足够长的时间后,白酒中的乙醇会完全消耗 | |
| B. | 一定条件下,达到限度后,反应会完全停止 | |
| C. | 反应达到平衡后,各组分的浓度一定相等 | |
| D. | 当C2H5OH的消耗速率等于CH3COOH的生成速率时,反应达到平衡 |

(1)铝热法冶炼金属铬,是利用了金属铝的还原性(填“氧化性”或“还原性”).
(2)溶液1中的阴离子有CrO42-、AlO2-、OH-.
(3)过程Ⅰ,在Cr2O3参与的反应中,若生成0.4mol CrO42-,消耗氧化剂的物质的量是0.3 mol.
(4)通入CO2调节溶液pH实现物质的分离.
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al.冶炼Al的化学方程式是2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$3O2↑+4Al.
②滤渣B受热分解所得物质可以循环利用,B是NaHCO3.
③已知:2CrO42-+2H+?Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是0.01mol/L.
(5)过程Ⅱ的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7.
不同温度下化合物的溶解度(g/100gH2O)
| 化合物名称 | 0°C | 20°C | 40°C | 60°C | 80°C |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
| Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积(Ksp) | 1.4×10-10 | 1.4×10-5 | 1.4×10-50 | 1.4×10-13 | 1.4×10-16 |
| A. | 在AgCl、Ag2SO4、AgBr、AgI饱和溶液中分别滴加Na2S溶液,均会生成相同的沉淀 | |
| B. | 25℃时,5种银盐饱和溶液中c(Ag+)最大的是Ag2SO4饱和溶液 | |
| C. | 25℃时,在等物质的量浓度的NaCl溶液和CaCl2溶液中加入足量的AgCl固体,形成饱和溶液,两溶液中AgCl溶度积相同,但c(Ag+)不同 | |
| D. | AgBr沉淀可转化为AgI沉淀,而AgI沉淀不可能转化为AgBr沉淀 |
| A. | 将乙烯通入溴水中、苯与溴水混合,两种情况下“溴水层”都褪色,且原理相同 | |
| B. | 有机物  的分子式为C6H10Br2 的分子式为C6H10Br2 | |
| C. | CH2=CH2、 、 、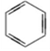 三种物质中都含有碳碳双键,都可发生加成反应 三种物质中都含有碳碳双键,都可发生加成反应 | |
| D. | 通过乙烷与少量的Cl2发生取代反应可制取较纯净的CH3CH2Cl |
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 反应至6min时,c(H2O2)=0.3mol/L | |
| B. | 反应至6min时,H2O2分解了50% | |
| C. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L?min) | |
| D. | 6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L?min) |