题目内容
13.下列叙述正确的是( )| A. | 常温下向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| B. | 常温下向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| C. | 常温下向水中加入少量固体CH3COONa,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 常温下将水加热,Kw不变 |
分析 A.向水中加入少量固体硫酸氢钠,c (H+)增大,平衡逆向移动;但Kw只与温度有关;
B.向水中加入少量稀氨水,氢氧根离子浓度增大,平衡逆向移动,c(H+)降低;
C.向水中加入少量固体CH3COONa,醋酸根离子结合氢离子,c(H+)降低,平衡正向移动;
D.水的电离是吸热过程,升高温度,平衡正向移动;
解答 解:A.向水中加入少量固体硫酸氢钠,c (H+)增大,平衡逆向移动;但Kw只与温度有关,故保持不变,故A正确;
B.向水中加入少量稀氨水,氢氧根离子浓度增大,平衡逆向移动,c(H+)降低,c(OH-)增大,故B错误;
C.向水中加入少量固体CH3COONa,醋酸根离子结合氢离子,c(H+)降低,平衡正向移动,故C错误;
D.水的电离是吸热过程,升高温度,平衡正向移动,Kw增大,氢离子浓度增大,故pH减小,故D错误;
故选A.
点评 本题考查水的电离的影响因素,题目难度不大.要注意Kw只与温度有关.

练习册系列答案
 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目
15.已建立平衡的某可逆反应,当改变条件使化学平衡向正反应方向移动时,下列叙述正确的是( )
(1)生成物的体积分数一定增加(2)生成物的产量一定增加(3)反应物的转化率一定增大(4)反应物浓度一定降低(5)正反应速率一定大于逆反应(6)加入催化剂.
(1)生成物的体积分数一定增加(2)生成物的产量一定增加(3)反应物的转化率一定增大(4)反应物浓度一定降低(5)正反应速率一定大于逆反应(6)加入催化剂.
| A. | (1)(2) | B. | (2)(5) | C. | (3)(5) | D. | (4)(6) |
1.利用熔融碱焙烧工艺可从铝热法生产金属铬所得铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,实现铬和铝的再生利用.其工作流程如图:

(1)铝热法冶炼金属铬,是利用了金属铝的还原性(填“氧化性”或“还原性”).
(2)溶液1中的阴离子有CrO42-、AlO2-、OH-.
(3)过程Ⅰ,在Cr2O3参与的反应中,若生成0.4mol CrO42-,消耗氧化剂的物质的量是0.3 mol.
(4)通入CO2调节溶液pH实现物质的分离.
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al.冶炼Al的化学方程式是2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$3O2↑+4Al.
②滤渣B受热分解所得物质可以循环利用,B是NaHCO3.
③已知:2CrO42-+2H+?Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是0.01mol/L.
(5)过程Ⅱ的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7.
不同温度下化合物的溶解度(g/100gH2O)
结合表中数据分析,过程Ⅱ得到K2Cr2O7粗品的操作是:向滤液③中加入稀盐酸和KCl固体后,蒸发浓缩、降温结晶,过滤得到K2Cr2O7粗品.

(1)铝热法冶炼金属铬,是利用了金属铝的还原性(填“氧化性”或“还原性”).
(2)溶液1中的阴离子有CrO42-、AlO2-、OH-.
(3)过程Ⅰ,在Cr2O3参与的反应中,若生成0.4mol CrO42-,消耗氧化剂的物质的量是0.3 mol.
(4)通入CO2调节溶液pH实现物质的分离.
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al.冶炼Al的化学方程式是2Al2O3(熔融)$\frac{\underline{\;通电\;}}{\;}$3O2↑+4Al.
②滤渣B受热分解所得物质可以循环利用,B是NaHCO3.
③已知:2CrO42-+2H+?Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是0.01mol/L.
(5)过程Ⅱ的目的是得到K2Cr2O7粗品,粗品再重结晶可制得纯净的K2Cr2O7.
不同温度下化合物的溶解度(g/100gH2O)
| 化合物名称 | 0°C | 20°C | 40°C | 60°C | 80°C |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
| KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
| K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
| K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
| Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
8.表是25℃时5种银盐的溶度积常数(Ksp):
下列说法中不正确的是( )
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积(Ksp) | 1.4×10-10 | 1.4×10-5 | 1.4×10-50 | 1.4×10-13 | 1.4×10-16 |
| A. | 在AgCl、Ag2SO4、AgBr、AgI饱和溶液中分别滴加Na2S溶液,均会生成相同的沉淀 | |
| B. | 25℃时,5种银盐饱和溶液中c(Ag+)最大的是Ag2SO4饱和溶液 | |
| C. | 25℃时,在等物质的量浓度的NaCl溶液和CaCl2溶液中加入足量的AgCl固体,形成饱和溶液,两溶液中AgCl溶度积相同,但c(Ag+)不同 | |
| D. | AgBr沉淀可转化为AgI沉淀,而AgI沉淀不可能转化为AgBr沉淀 |
18.为除去CO2气体中混有的少量SO2气体杂质,可以采用的方法是( )
| A. | 通过酸性高锰酸钾溶液 | B. | 通过澄清石灰水 | ||
| C. | 通过饱和Na2CO3溶液 | D. | 通过氢氧化钠溶液 |
5.有关有机物结构和性质的说法中正确的是( )
| A. | 将乙烯通入溴水中、苯与溴水混合,两种情况下“溴水层”都褪色,且原理相同 | |
| B. | 有机物  的分子式为C6H10Br2 的分子式为C6H10Br2 | |
| C. | CH2=CH2、 、 、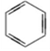 三种物质中都含有碳碳双键,都可发生加成反应 三种物质中都含有碳碳双键,都可发生加成反应 | |
| D. | 通过乙烷与少量的Cl2发生取代反应可制取较纯净的CH3CH2Cl |
2.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 氢氧化铜可溶于氨水说明氢氧化铜是两性氢氧化物 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
3.下列离子方程式或化学方程式错误的是( )
| A. | 用H2O2氧化水中的I-:2I-+2H++H2O2=I2+2H2O | |
| B. | 将煤气化为可燃性气体:C(g)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g) | |
| C. | 用过量NaOH溶液吸收烟气中的SO2:SO2+NaOH=NaHSO3 | |
| D. | 燃煤中加入石灰石脱硫:2CaCO3+2SO2+O2═2CaSO4+2CO2 |