题目内容
15.下列离子可以大量共存的是( )| A. | Fe3+、Na+、I-、Cl- | B. | Al3+、NO3-、Cl-、K+ | ||
| C. | K+、H+、HCO3-、SO42- | D. | Cu2+、Na+、SO42-、Cl- |
分析 A.铁离子能够氧化碘离子;
B.四种离子之间不反应,能够大量共存;
C.碳酸氢根离子与氢离子反应;
D.四种离子之间不反应,能够共存.
解答 解:A.Fe3+、I-之间发生氧化还原反应,在溶液中不能大量共存,故A错误;
B.Al3+、NO3-、Cl-、K+之间不反应,在溶液中能够大量共存,故B正确;
C.H+、HCO3-之间发生反应,在溶液中不能大量共存,故C错误;
D.Cu2+、Na+、SO42-、Cl-之间不反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,题目难度不大,明确离子反应发生条件为解答关键,注意掌握离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案
相关题目
5.有关有机物结构和性质的说法中正确的是( )
| A. | 将乙烯通入溴水中、苯与溴水混合,两种情况下“溴水层”都褪色,且原理相同 | |
| B. | 有机物  的分子式为C6H10Br2 的分子式为C6H10Br2 | |
| C. | CH2=CH2、 、 、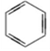 三种物质中都含有碳碳双键,都可发生加成反应 三种物质中都含有碳碳双键,都可发生加成反应 | |
| D. | 通过乙烷与少量的Cl2发生取代反应可制取较纯净的CH3CH2Cl |
6.一定温度下,10mL0.40mol/L H2O2溶液发生催化分解.不同时刻测定生成O2的体积(已折算为标准状况)如下表.
下列叙述不正确的是(溶液体积变化忽略不计)( )
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 反应至6min时,c(H2O2)=0.3mol/L | |
| B. | 反应至6min时,H2O2分解了50% | |
| C. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L?min) | |
| D. | 6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L?min) |
3.下列离子方程式或化学方程式错误的是( )
| A. | 用H2O2氧化水中的I-:2I-+2H++H2O2=I2+2H2O | |
| B. | 将煤气化为可燃性气体:C(g)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g) | |
| C. | 用过量NaOH溶液吸收烟气中的SO2:SO2+NaOH=NaHSO3 | |
| D. | 燃煤中加入石灰石脱硫:2CaCO3+2SO2+O2═2CaSO4+2CO2 |
10.下列化学用语表述不正确的是( )
| A. | CO2的电子式: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 水分子的球棍模型: | D. | 35Cl-离子的结构示意图: |
20. Mg-AgCl电池是一种用海水激活的一次电池,装置如图,其反应原理可表不为:Mg+2AgCl=MgCl2+2Ag.下列有关说法不正确的是( )
Mg-AgCl电池是一种用海水激活的一次电池,装置如图,其反应原理可表不为:Mg+2AgCl=MgCl2+2Ag.下列有关说法不正确的是( )
 Mg-AgCl电池是一种用海水激活的一次电池,装置如图,其反应原理可表不为:Mg+2AgCl=MgCl2+2Ag.下列有关说法不正确的是( )
Mg-AgCl电池是一种用海水激活的一次电池,装置如图,其反应原理可表不为:Mg+2AgCl=MgCl2+2Ag.下列有关说法不正确的是( )| A. | a电极是该电池的负极 | |
| B. | b电极发生氧化反应 | |
| C. | b电极的电极反应式为:2AgCl+2e-=2Ag+2Cl- | |
| D. | 电池工作时,电子从a电极经外电路流向b电极 |
7.一定能够鉴定卤代烃中卤元素的存在的操作是( )
| A. | 在卤代烃中直接加入AgNO3溶液 | |
| B. | 加入NaOH的水溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液 | |
| C. | 加蒸馏水,充分搅拌后,加入AgNO3溶液 | |
| D. | 加入NaOH的乙醇溶液,加热后加入AgNO3溶液 |
4.下列装置或操作能达到实验目的是( )


| A. | 图①所示实验能证明非金属性:S>C>Si | |
| B. | 图②装置可用于分离乙酸与乙醇的混合液 | |
| C. | 图③装置可以用来实验室制乙酸乙酯 | |
| D. | 图④装说可检验蔗糖是否水解 |
5.下列措施或事实不能用勒夏特列原理解释的是( )
| A. | 新制的氯水在光照下颜色变浅(Cl2+H2O?Cl-+HClO+H+) | |
| B. | H2、I2、HI平衡混合气加压后颜色变深 | |
| C. | 在合成氨的反应中,降温或加压有利于氨的合成 | |
| D. | Fe(SCN)3溶液中加入6mol/LNaOH溶液后颜色变浅 |