题目内容
14.在一定温度下向一个体积为2L固定容积的密闭容器中充入一定量的N2O4,进行如下化学反应:N2O4(g)?2NO2(g),请回答下列问题:(1)下列说法能够判断该反应已经达到化学平衡状态的是BD.
A.容器内混合气体密度不变
B.混合气体的压强不变
C.0.5molN2O4分解的同时有1molNO2生成
D.混合气体的颜色不变
(2)每隔一段时间对该密闭容器内的物质进行分析,得到如下数据:
| 时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(N2O4) (mol) | 2.80 | a | 2.00 | c | d | 1.60 |
| n(NO2) (mol) | 0 | 0.96 | b | 2.08 | 2.40 | 2.40 |
②达到化学平衡状态时,N2O4的平衡转化率为42.9%(或42.86%);
③20s~40s内用N2O4表示该反应的平均反应速率υ(N2O4)=0.01mol•L-1•s-1.
分析 (1)结合平衡的特征“等、定”及衍生的物理量判定平衡状态;
(2)①由表格数据可知,N2O4减少2.80mol-2.00mol=0.80mol,结合N2O4(g)?2NO2(g)计算;
②由表格数据可知,80s达到平衡状态,生成NO2为2.40mol,由反应可知参加反应的N2O4为1.20mol;
③结合v=$\frac{△c}{△t}$、速率之比等于化学计量数之比来计算.
解答 解:(1)A.混合气体的质量、体积不变,则容器内混合气体密度不变,不能判定平衡状态,故A不选;
B.该反应为气体体积增大的反应,则混合气体的压强不变,达到平衡状态,故B选;
C.0.5molN2O4分解的同时有1molNO2生成,只体现正反应速率,不能判定平衡状态,故C不选;
D.混合气体的颜色不变,可知c(NO2)不变,达到平衡状态,故D选;
故答案为:BD;
(2)①由表格数据可知,N2O4减少2.80mol-2.00mol=0.80mol,由N2O4(g)?2NO2(g)可知,b的值为0.08×2=0.16,
故答案为:0.16;
②由表格数据可知,80s达到平衡状态,生成NO2为2.40mol,由反应可知参加反应的N2O4为1.20mol,N2O4的平衡转化率为$\frac{1.20}{2.80}$×100%=42.9%(或42.86%),
故答案为:42.9%(或42.86%);
③20s~40s内用NO2表示该反应的平均反应速率为$\frac{\frac{0.96mol-0.16mol}{2L}}{20s}$=0.02 mol•L-1•s-1,由速率之比等于反应速率之比可知,20s~40s内用N2O4表示该反应的平均反应速率υ(N2O4)=0.02 mol•L-1•s-1×$\frac{1}{2}$=0.01 mol•L-1•s-1,
故答案为:0.01 mol•L-1•s-1.
点评 本题考查化学平衡,为高频考点,把握表格中数据、速率及转化率计算、平衡判定为解答的关键,侧重分析与应用能力的考查,注意表格数据的应用,题目难度不大.

 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案(1)生成物的体积分数一定增加(2)生成物的产量一定增加(3)反应物的转化率一定增大(4)反应物浓度一定降低(5)正反应速率一定大于逆反应(6)加入催化剂.
| A. | (1)(2) | B. | (2)(5) | C. | (3)(5) | D. | (4)(6) |
| A. | 将乙烯通入溴水中、苯与溴水混合,两种情况下“溴水层”都褪色,且原理相同 | |
| B. | 有机物  的分子式为C6H10Br2 的分子式为C6H10Br2 | |
| C. | CH2=CH2、 、 、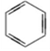 三种物质中都含有碳碳双键,都可发生加成反应 三种物质中都含有碳碳双键,都可发生加成反应 | |
| D. | 通过乙烷与少量的Cl2发生取代反应可制取较纯净的CH3CH2Cl |
| A. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| B. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| C. | 氢氧化铜可溶于氨水说明氢氧化铜是两性氢氧化物 | |
| D. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ |
| A. | 向2mL2%的CuSO4溶液中加入几滴1%的NaOH溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 | |
| B. | 室温下向苯和少量苯酚的混合溶液中加入适量浓溴水,振荡、静置后过滤,可除去苯中少量苯酚 | |
| C. | 向溴水中滴入植物油,振荡后,油层显无色,说明溴不溶于油脂 | |
| D. | 使用含NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙,说明Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3OH] |
| A. | 温室效应 | B. | 酸雨 | C. | 臭氧空洞 | D. | 光化学烟雾 |
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
| A. | 反应至6min时,c(H2O2)=0.3mol/L | |
| B. | 反应至6min时,H2O2分解了50% | |
| C. | 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L?min) | |
| D. | 6~10min的平均反应速率:v(H2O2)<3.3×10-2mol/(L?min) |
| A. | 用H2O2氧化水中的I-:2I-+2H++H2O2=I2+2H2O | |
| B. | 将煤气化为可燃性气体:C(g)+H2O(g)$\frac{\underline{\;高温\;}}{\;}$CO(g)+H2(g) | |
| C. | 用过量NaOH溶液吸收烟气中的SO2:SO2+NaOH=NaHSO3 | |
| D. | 燃煤中加入石灰石脱硫:2CaCO3+2SO2+O2═2CaSO4+2CO2 |

| A. | 图①所示实验能证明非金属性:S>C>Si | |
| B. | 图②装置可用于分离乙酸与乙醇的混合液 | |
| C. | 图③装置可以用来实验室制乙酸乙酯 | |
| D. | 图④装说可检验蔗糖是否水解 |