题目内容
20.已知NH3、H2S等分子是极性分子,CO2、BF3、CCl4等分子是由极性键构成的非极性分子,据以上事实,可推出ABn型分子是非极性分子的经验规律( )| A. | 分子中不能含有氢原子 | |
| B. | 在ABn型分子中A的相对原子质量应小于B的相对原子质量 | |
| C. | 在ABn型分子中A原子最外层没有孤对电子,即价电子全部成键 | |
| D. | 分子中每个共价键的键长应相等 |
分析 共价键的极性是由于成键两原子对电子的引力不同,而使共用电子对不在中央,发生偏移,导致键两端显部分的电极之故,ABn型分子中A原子的所有价电子都参与成键,与相对原子质量大小、健长、以及是否含有H原子无关.
解答 解:A.分子中不含有H原子的分子不一定是非极性分子,如PCl3是极性分子,故A错误;
B.PCl3分子中P原子量小于氯原子,但PCl3是极性分子,故B错误;
C.在ABn分子中A原子的所有价电子都构成共价键,导致结构对称、正负电荷重心重叠,所以为非极性分子,故C正确;
D.H2S分子中两个S-H键的键长都相等,但硫化氢分子是极性分子,故D错误;
故选C.
点评 本题考查极性分子好和非极性分子,题目难度不大,注意从分子结构是否对称判断分子的极性,学会利用实例来分析.

练习册系列答案
相关题目
1.下列共价化合物中,共价键的键能最小的是( )
| A. | HCl | B. | HF | C. | HBr | D. | HI |
2.陈年的白酒中会发生反应:C2H5OH+CH3COOH?C2H5OOCCH3+H2O,下列有关说法正确的是( )
| A. | 陈放足够长的时间后,白酒中的乙醇会完全消耗 | |
| B. | 一定条件下,达到限度后,反应会完全停止 | |
| C. | 反应达到平衡后,各组分的浓度一定相等 | |
| D. | 当C2H5OH的消耗速率等于CH3COOH的生成速率时,反应达到平衡 |
8.表是25℃时5种银盐的溶度积常数(Ksp):
下列说法中不正确的是( )
| 化学式 | AgCl | Ag2SO4 | Ag2S | AgBr | AgI |
| 溶度积(Ksp) | 1.4×10-10 | 1.4×10-5 | 1.4×10-50 | 1.4×10-13 | 1.4×10-16 |
| A. | 在AgCl、Ag2SO4、AgBr、AgI饱和溶液中分别滴加Na2S溶液,均会生成相同的沉淀 | |
| B. | 25℃时,5种银盐饱和溶液中c(Ag+)最大的是Ag2SO4饱和溶液 | |
| C. | 25℃时,在等物质的量浓度的NaCl溶液和CaCl2溶液中加入足量的AgCl固体,形成饱和溶液,两溶液中AgCl溶度积相同,但c(Ag+)不同 | |
| D. | AgBr沉淀可转化为AgI沉淀,而AgI沉淀不可能转化为AgBr沉淀 |
15.下列反应中能产生SO2的是( )
①硫在空气中燃烧 ②亚硫酸钠和硫酸反应 ③碳和热的浓硫酸反应 ④铜和热的浓硫酸反应.
①硫在空气中燃烧 ②亚硫酸钠和硫酸反应 ③碳和热的浓硫酸反应 ④铜和热的浓硫酸反应.
| A. | ①③④ | B. | ③④ | C. | ②③④ | D. | ①②③④ |
5.有关有机物结构和性质的说法中正确的是( )
| A. | 将乙烯通入溴水中、苯与溴水混合,两种情况下“溴水层”都褪色,且原理相同 | |
| B. | 有机物  的分子式为C6H10Br2 的分子式为C6H10Br2 | |
| C. | CH2=CH2、 、 、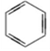 三种物质中都含有碳碳双键,都可发生加成反应 三种物质中都含有碳碳双键,都可发生加成反应 | |
| D. | 通过乙烷与少量的Cl2发生取代反应可制取较纯净的CH3CH2Cl |
12.14C的放射性可用于考古断代.下列关于14C的说法中正确的是( )
| A. | 质量数为6 | B. | 质子数为6 | ||
| C. | 电子数为14 | D. | C的相对原子质量为14 |
9.下列叙述正确的是( )
| A. | 向2mL2%的CuSO4溶液中加入几滴1%的NaOH溶液,振荡后再加入0.5mL有机物X,加热后未出现砖红色沉淀,说明X结构中不含有醛基 | |
| B. | 室温下向苯和少量苯酚的混合溶液中加入适量浓溴水,振荡、静置后过滤,可除去苯中少量苯酚 | |
| C. | 向溴水中滴入植物油,振荡后,油层显无色,说明溴不溶于油脂 | |
| D. | 使用含NaF的牙膏,可以使牙齿上的Ca5(PO4)3OH转化为Ca5(PO4)3F,防止蛀牙,说明Ksp[Ca5(PO4)3F]<Ksp[Ca5(PO4)3OH] |
10.下列化学用语表述不正确的是( )
| A. | CO2的电子式: | B. | 乙烯的结构简式:CH2CH2 | ||
| C. | 水分子的球棍模型: | D. | 35Cl-离子的结构示意图: |