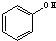
题目内容
5.某同学探究某有机物A的结构,进行如下实验:①取6.0克A在氧气中完全燃烧,将生成气体依次通过M(装有浓硫酸)和N(装有碱石灰)洗气瓶,M增重7.2克,N增重13.2克.
②测定相对分子质量为60.
③测定核磁共振氢谱,有三个强峰,比值为6:1:1
据此回答下列问题:
(1)②中测定相对分子质量的方法为质谱法;
(2)写出A的分子式C3H8O;
(3)A发生消去反应的化学方程式CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2+H2O;
(4)A与乙酸反应的化学方程式CH3COOH+HO-CH(CH3)2$→_{△}^{浓硫酸}$CH3COOCH(CH3)2+H2O.
分析 (1)测定有机物相对分子质量的方法为质谱法;
(2)浓硫酸增重的为水的质量、碱石灰增重的为二氧化碳的质量,根据n=$\frac{m}{M}$计算出有机物、水和二氧化碳的物质的量,然后根据质量守恒定律确定其分子式;
(3)根据测定的核磁共振氢谱判断其结构简式,然后写出其在浓硫酸作用下加热发生消去反应的化学方程式;
(4)CH3CH(OH)CH3分子中含有羟基,能够发生酯化反应,根据酯化反应原理写出该反应的化学方程式.
解答 解:(1)通过质谱法可以测定出有机物的相对分子质量,故答案为:质谱法;
(2)6.0g该有机物的物质的量为:$\frac{6.0g}{60g/mol}$=0.1mol,
7.2g水的物质的量为:$\frac{7.2g}{18g/mol}$=0.4mol,含有H原子的物质的量为0.8mol,质量为:1g/mol×0.8mol=0.8g,
13.2g二氧化碳的物质的量为:$\frac{13.2g}{44g/mol}$=0.3mol,12g/mol×0.3mol=3.6g,
3.6g+0.8g=4.4g<6.0g,
则该有机物中一定含有氧元素,其物质的量为:$\frac{6.0g-4.4g}{16g/mol}$=0.1mol,
则该有机物分子中含有C、H、O原子的数目为:N(C)=$\frac{0.3mol}{0.1mol}$=3、N(H)=$\frac{0.8mol}{0.1mol}$=8、N(O)=$\frac{0.1mol}{0.1mol}$=1,
故该有机物分子式为:C3H8O,
故答案为:C3H8O;
(3)测定核磁共振氢谱,有三个强峰,比值为6:1:1,说明其分子中含有2个甲基,则该有机物的结构简式为:CH3CH(OH)CH3,其发生消去反应的化学方程式为:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O,
故答案为:CH3CH(OH)CH3$→_{△}^{浓硫酸}$CH3CH=CH2↑+H2O;
(4)CH3CH(OH)CH3分子中含有羟基,能够发生酯化反应,CH3CH(OH)CH3与乙酸发生酯化反应的化学方程式为:CH3COOH+HO-CH(CH3)2$→_{△}^{浓硫酸}$CH3COOCH(CH3)2+H2O,
故答案为:CH3COOH+HO-CH(CH3)2$→_{△}^{浓硫酸}$CH3COOCH(CH3)2+H2O.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,明确常见有机物结构与性质为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用.

| A. | 同分异构体因结构不同,化学性质一定差别很大 | |
| B. | 具有相同通式的有机物不一定互为同系物 | |
| C. | 两个相邻同系物的相对分子质量数值一定相差14 | |
| D. | 同分异构体不可能互为同系物 |
| A. | 往反应后的溶液中加入AgNO3溶液检验是否有Br-生成 | |
| B. | 实验中观察不到有气体生成 | |
| C. | 生成的气体可直接通入到溴水中检验是否有乙烯生成 | |
| D. | 生成的气体可直接通入到酸性高锰酸钾溶液中检验是否有乙烯生成 |
CrO${\;}_{4}^{2-}$(黄色)$→_{①转化}^{H+}$Cr2O${\;}_{7}^{2-}$(橙色)$→_{②还原}^{Fe_{2}+}$Cr3+$→_{③沉淀}^{OH-}$Cr(OH)3↓
已知:步骤③生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:
Cr(OH)3(s)?Cr3+(aq)+3OH-(aq) Ksp=c(Cr3+)•c3(OH-)=10-32
下列有关说法不正确的是( )
| A. | 步骤①中当v正(CrO42-)=2v逆(Cr2O72-)时,说明反应:2CrO42-+2H+?Cr2O72-+H2O 达到平衡状态 | |
| B. | 若向K2Cr2O7溶液中加NaOH浓溶液,溶液可由橙色变黄色 | |
| C. | 步骤②中,若要还原1 mol Cr2O72-离子,需要12 mol (NH4)2Fe(SO4)2 | |
| D. | 步骤③中,当将溶液的pH 调节至5 时,可认为废水中的铬元素已基本除尽(当溶液中c(Cr3+)≤10-5 mol/L时,可视作该离子沉淀完全) |
| A. | ${\;}_{55}^{133}Cs$和${\;}_{55}^{137}Cs$互为同位素 | |
| B. | ${\;}_{67}^{166}Ho$的原子核内的中子数与核外电子数之差为32 | |
| C. | 元素周期表中L层电子为奇数的元素所在族序数与该元素原子的L层电子数相等 | |
| D. | 1 mol KHSO4加热熔化可电离出2NA个阳离子 |
| A. | 乙烷 | B. | 乙炔 | C. | 乙烯 | D. | 苯 |
| A. | 2-甲基-2-丁炔 | B. | 1,3,4-三甲苯 | C. | 3-甲基-2-丁烯 | D. | 2-乙基-2-丁烯 |
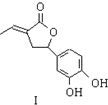 内酯类化合物在药物、涂料等应用广泛.
内酯类化合物在药物、涂料等应用广泛. +$\frac{1}{2}$O2+CO2$\stackrel{催化剂}{→}$
+$\frac{1}{2}$O2+CO2$\stackrel{催化剂}{→}$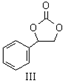
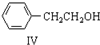 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$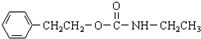 +H2O
+H2O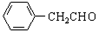 ;由IV生成II的反应条件为浓硫酸、加热.
;由IV生成II的反应条件为浓硫酸、加热.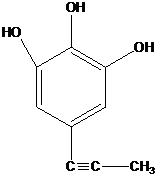 .
.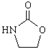 ,涉及的反应方程式为BrCH2CH2-NH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH2NH2、HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$
,涉及的反应方程式为BrCH2CH2-NH2+NaOH$→_{△}^{H_{2}O}$HOCH2CH2NH2、HOCH2CH2NH2+CO2$\stackrel{催化剂}{→}$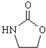 +H2O.
+H2O.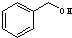 与
与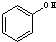 ⑥
⑥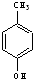 与
与